14.8 Éteres
Objetivos de aprendizaje
- Describir la diferencia estructural entre un alcohol y un éter que afecta a las características físicas y a la reactividad de cada uno.
- Nombrar éteres simples.
- Describir la estructura y usos de algunos éteres.
Con la fórmula general ROR′, un éterCompuesto orgánico que tiene un átomo de oxígeno entre dos grupos hidrocarburos. puede considerarse un derivado del agua en el que ambos átomos de hidrógeno se sustituyen por grupos alquilo o arilo. También puede considerarse un derivado de un alcohol (ROH) en el que el átomo de hidrógeno del grupo OH se ha sustituido por un segundo grupo alquilo o arilo:
HOH→Atomos de Hreemplazar ambosROR′←del grupo OHreemplazar el átomo de HROH
Los éteres simples tienen nombres comunes simples, formados a partir de los nombres de los grupos unidos al átomo de oxígeno, seguidos del nombre genérico éter. Por ejemplo, CH3-O-CH2CH3 es éter de metilo y propilo. Si ambos grupos son iguales, el nombre del grupo debe ir precedido del prefijo di-, como en el éter dimetílico (CH3-O-CH3) y el éter dietílico CH3CH2-O-CH2CH3.
Las moléculas de éter no tienen ningún átomo de hidrógeno en el átomo de oxígeno (es decir, no hay grupo OH). Por lo tanto, no hay enlace de hidrógeno intermolecular entre las moléculas de éter, y los éteres, por lo tanto, tienen puntos de ebullición bastante bajos para una masa molar dada. De hecho, los éteres tienen puntos de ebullición casi iguales a los de los alcanos de masa molar comparable y mucho más bajos que los de los alcoholes correspondientes (Tabla 14.4 «Comparación de los puntos de ebullición de alcanos, alcoholes y éteres»).
Tabla 14.4 Comparación de los puntos de ebullición de alcanos, alcoholes y éteres
| Fórmula estructural condensada | Nombre | Masa polar | Punto de ebullición (°C) | ¿Enlace intermolecular de hidrógeno en líquido puro? |
|---|---|---|---|---|
| CH3CH2CH3 | propano | 44 | -42 | no |
| CH3OCH3 | dimetil éter | 46 | -25 | no |
| CH3CH2OH | alcohol etílico | 46 | 78 | sí |
| CH3CH2CH2CH3 | pentano | 72 | 36 | no |
| CH3CH2OCH3 | dietil éter | 74 | 35 | no |
| CH3CH2CH2OH | alcohol butílico | 74 | 117 | sí |
Las moléculas de éter tienen un átomo de oxígeno, sin embargo, y participan en el enlace de hidrógeno con las moléculas de agua. En consecuencia, un éter tiene aproximadamente la misma solubilidad en agua que el alcohol que es isomérico con él. Por ejemplo, el éter dimetílico y el etanol (ambos con la fórmula molecular C2H6O) son completamente solubles en agua, mientras que el éter dietílico y el 1-butanol (ambos C4H10O) son apenas solubles en agua (8 g/100 mL de agua).
Ejemplo 5
¿Cuál es el nombre común de cada éter?
- CH3CH2CH2OCH2CH3
-
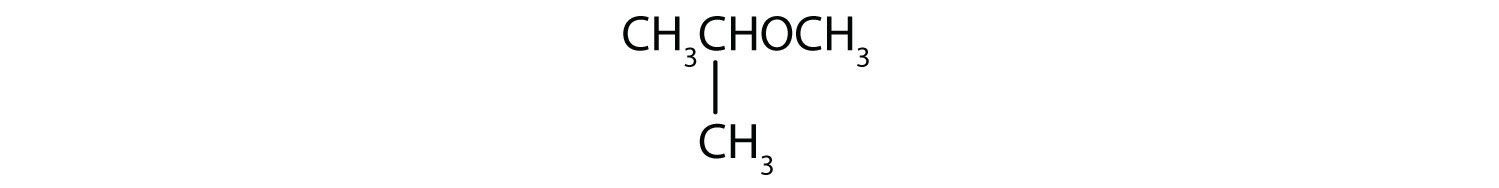
Solución
- Los grupos de carbono a ambos lados del átomo de oxígeno son grupos propilo (CH3CH2CH2), por lo que el compuesto es éter dipropílico.
- El grupo de tres carbonos está unido por el átomo de carbono del medio, por lo que es un grupo isopropilo. El grupo de un carbono es un grupo metilo. El compuesto es éter metílico isopropílico.
Ejercicio de habilidad
-
CH3CH2CH2OCH2CH2CH3
-
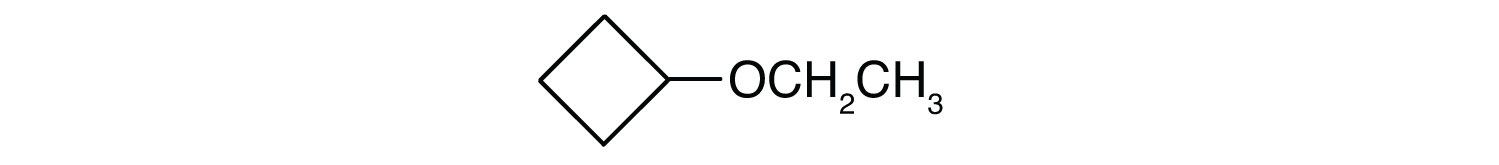
¿Cuál es el nombre común de cada éter?
A su salud: Los éteres como anestésicos generales
Un anestésico general actúa sobre el cerebro para producir la inconsciencia y una insensibilidad general a la sensación o al dolor. El éter dietílico (CH3CH2OCH2CH3) fue el primer anestésico general que se utilizó.
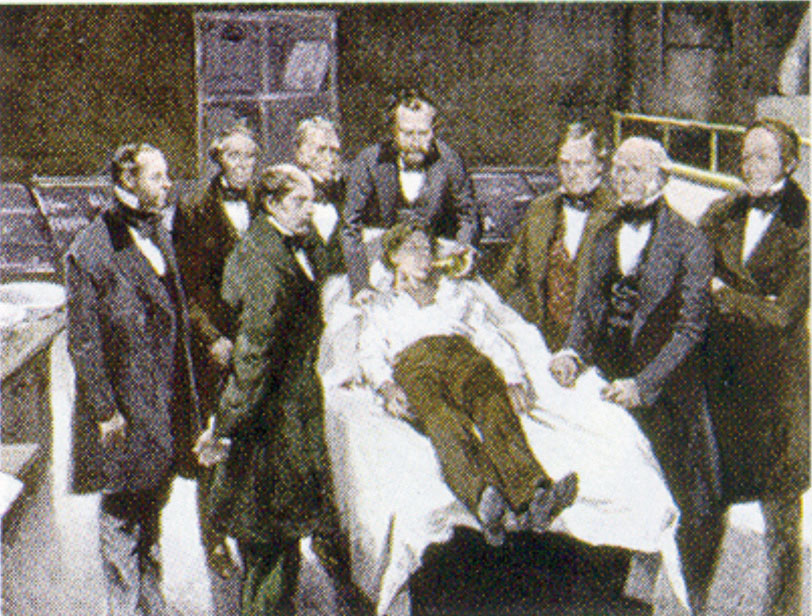
William Morton, un dentista de Boston, introdujo el éter dietílico en la práctica quirúrgica en 1846. Este cuadro muestra una operación en Boston en 1846 en la que se utilizó el éter dietílico como anestésico. La inhalación de vapor de éter produce inconsciencia al deprimir la actividad del sistema nervioso central.
Fuente: Pintura de William Morton por Ernest Board, a partir de http://commons.wikimedia.org/wiki/File:Morton_Ether_1846.jpg.
El éter etílico es relativamente seguro porque hay una diferencia bastante amplia entre la dosis que produce un nivel eficaz de anestesia y la dosis letal. Sin embargo, debido a que es altamente inflamable y tiene la desventaja añadida de causar náuseas, ha sido sustituido por nuevos anestésicos inhalantes, incluyendo los compuestos que contienen flúor: halotano, enflurano e isoflurano. Por desgracia, se ha cuestionado la seguridad de estos compuestos para el personal de los quirófanos. Por ejemplo, las trabajadoras de quirófano expuestas al halotano sufren una mayor tasa de abortos espontáneos que las mujeres de la población general.
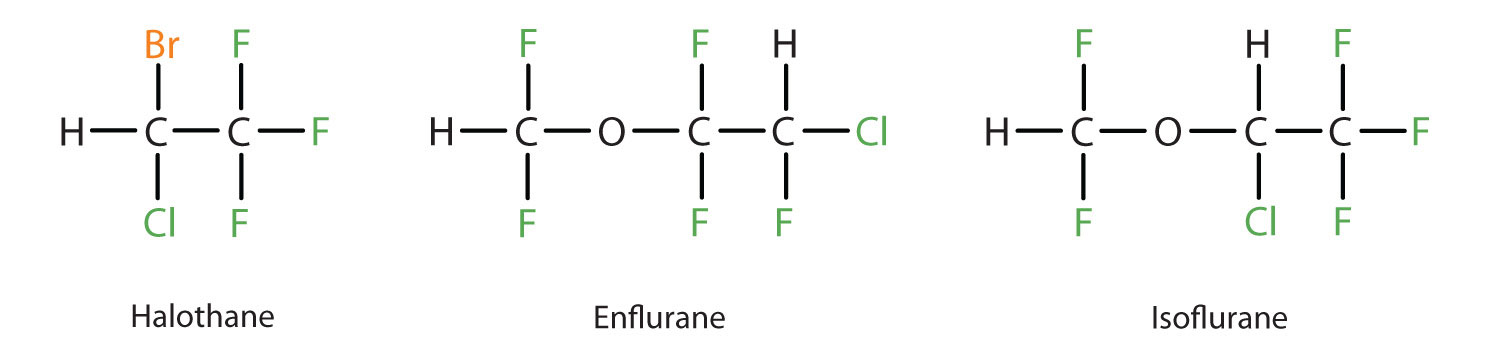
Estos tres modernos compuestos anestésicos inhalantes que contienen halógenos son menos inflamables que el éter dietílico.
Ejercicios de repaso de conceptos
-
¿Por qué el éter dietílico (CH3CH2OCH2CH3) tiene un punto de ebullición mucho más bajo que el 1-butanol (CH3CH2CH2OH)?
-
¿Qué es más soluble en agua: el éter metílico (CH3CH2OCH3) o el 1-butanol (CH3CH2CH2OH)? Explique.
Respuestas
-
El éter metílico no tiene enlace de hidrógeno intermolecular porque no hay grupo OH; el 1-butanol tiene un OH y participa en el enlace de hidrógeno intermolecular.
-
El éter metílico de etilo (tres átomos de carbono, un átomo de oxígeno) es más soluble en agua que el 1-butanol (cuatro átomos de carbono, un átomo de oxígeno), aunque ambos pueden participar en el enlace de hidrógeno con el agua.
Consultas clave
- Para dar nombres comunes a los éteres, basta con nombrar los grupos unidos al átomo de oxígeno, seguidos del nombre genérico éter. Si ambos grupos son iguales, el nombre del grupo debe ir precedido del prefijo di-.
- Las moléculas de éter no tienen grupo OH y, por tanto, no tienen enlace de hidrógeno intermolecular. Por lo tanto, los éteres tienen puntos de ebullición bastante bajos para una masa molar dada.
- Las moléculas de éter tienen un átomo de oxígeno y pueden participar en el enlace de hidrógeno con las moléculas de agua. Una molécula de éter tiene aproximadamente la misma solubilidad en agua que el alcohol que es isomérico con ella.
Ejercicios
-
¿Cómo puede el etanol dar dos productos diferentes cuando se calienta con ácido sulfúrico? Nombra estos productos.
-
¿Cuál de estos éteres es isomérico con el etanol-CH3CH2OCH2CH3, CH3OCH2CH3, o CH3OCH3?
-
Nombre cada compuesto.
- CH3OCH2CH3
-
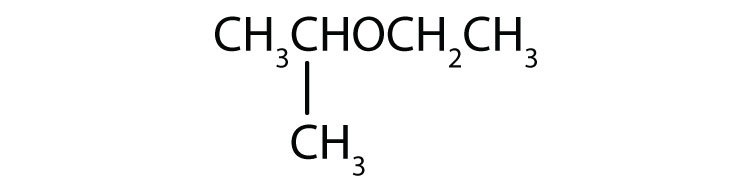
-
Nombre cada compuesto.
- CH3CH2CH2OCH3
- CH3CH2OCH2CH3
-
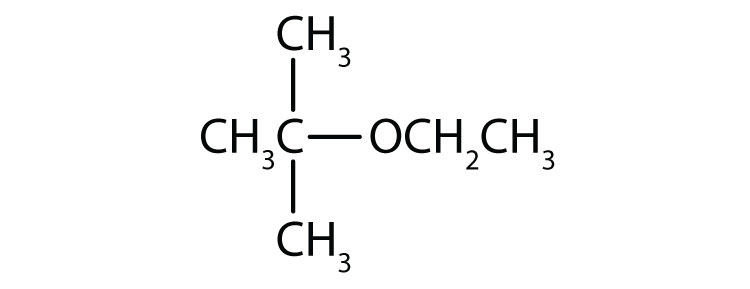
Dibuja la estructura de cada compuesto.
- Etil éter
- tert-butil éter
-
Dibuja la estructura para cada compuesto.
- diisopropil éter
- ciclopropil propil éter
Respuestas
-
La deshidratación intramolecular (tanto el H como el OH provienen de la misma molécula) da etileno; intermolecular (el H procede de una molécula y el OH de otra) la deshidratación da éter dietílico.
-
- metil propil éter
- etil isopropil éter
-
- CH3OCH2CH3
-
Deja una respuesta