Lewisstruktur for carbonat-ion er tegnet trin for trin i denne vejledning. Begrebet samlede valenselektroner bruges til at tegne Lewis-strukturen for CO32-. Efter færdiggørelsen af lewis-strukturen af CO32- skal der være en -2 ladning og en stabilitet. Du vil lære om disse ting i denne tutorial.
- Carbonat-ion | CO32-
- CO32- Lewis-struktur
- Trin for tegning af lewis-struktur af CO32-
- Totalt antal elektroner i CO32-
- Totale valenselektronpar
- Centeratom i CO32-ionen
- Enlige par på atomer
- Ladninger på atomer
- Tjek stabiliteten og minimer ladninger på atomer ved at omdanne lone par til bindinger
- Lewis-struktur af CO32- (carbonat) ion
- carbonat lewis-struktur og bikarbonat lewis-struktur
Carbonat-ion | CO32-
Carbonat-ionen har en -2 ladning. Metalcarbonatforbindelser er almindelige i verden. Som et CaCO3 kan gives.
CO32- Lewis-struktur
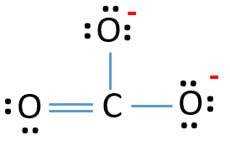
Der er tre σ-bindinger og π-bindinger omkring kulstofatomet i Lewis-strukturen af CO32-ionen.
Trin for tegning af lewis-struktur af CO32-
Følgende trin er nødvendige for at tegne CO32- lewis-strukturen, og de er forklaret detaljeret i denne vejledning.
- Find det samlede antal elektroner i kulstof- og oxygenatomernes valanceskaller
- Totale elektronpar
- Centeratomvalg
- Sæt lone par på atomer
- Kontroller stabiliteten og minimer ladningerne på atomer ved at konvertere lone par til bindinger.
Det er vigtigt at tegne korrekt lewis-struktur for at tegne resonansstrukturer af CO32- korrekt.
Totalt antal elektroner i CO32-
Kulstof er placeret i gruppe 4 i det periodiske system. Kulstof har altså fire elektroner i sin valensskal.Oxygen er placeret i 6. gruppe. Det har seks elektroner i valensskallen.
- Totale valenselektroner givet af kulstofatomet = 4
Der er tre oxygenatomer i CO32- ionen, Derfor
- Totale valenselektroner givet af oxygenatomer = 6 *3 = 18
Der er -2 ladning på CO32- ionen. Derfor er der to ekstra elektroner, som bidrager til valenselektronerne.
- Totale valenselektroner = 4 + 18 + 2 = 24
Totale valenselektronpar
Totale valenselektronpar = σ-bindinger + π-bindinger + lone par ved valensskaller
Totale elektronpar bestemmes ved at dividere antallet samlede valenselektroner med to. For CO32-ionen er det samlede antal elektronpar 12.
Centeratom i CO32-ionen
For at være centeratom er det vigtigt at have en højere valensværdi. Kulstof har størst chance for at være centeratom (Se figuren), fordi kulstof kan vise valens på 4. Oxygen’s højeste valens er 2. Så nu kan vi opbygge en skitse af CO32- ionen.
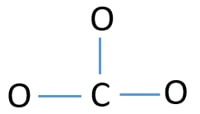
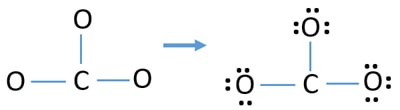
Enlige par på atomer
- Der er allerede tre C-O bindinger i ovenstående skitse. Derfor er der kun ni (12-3 = 9) valenselektronpar tilbage.
- Først markeres disse ni valenselektronpar som ensomme par på de ydre atomer (på oxygenatomer). Et oxygenatom vil tage tre ensomme par efter oktalreglen (oxygenatomet kan ikke beholde mere end otte elektroner i sin valensskal).
- Til tre oxygenatomer er der brugt ni elektronpar. Nu er der ikke flere ensomme par at markere på kulstofatomer efter at have markeret på oxygenatomer (udenfor atomer).
Ladninger på atomer
Efter at have markeret elektronpar på atomer, skal vi markere ladninger på hvert atom. Markeringen af ladninger er vigtig, fordi den bruges til at bestemme ionens bedste lewis-struktur. Efter markering af ladninger vil du se, at hvert iltatom får en -1 ladning og kulstofatom får en +1 ladning.
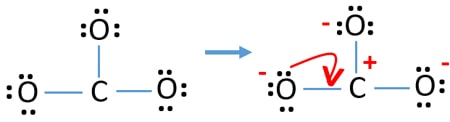
Tjek stabiliteten og minimer ladninger på atomer ved at omdanne lone par til bindinger
- Syreatomer skal have negative ladninger, fordi iltatomets elektronegativitet er højere end kulstofatomets. Ellers kan vi sige, at evnen til at holde negative ladninger er større hos iltatomer end hos kulstofatomer.
- Den tegnede struktur er ikke stabil, fordi alle atomer har en ladning (Lewis-strukturen burde være en stabil struktur med færre ladninger).
- Nu skal vi forsøge at minimere ladningerne ved at omdanne et eller flere ensomme par til bindinger. Altså omdanne et lone par på et oxygenatom til en C-O binding.
- Nu er der en dobbeltbinding mellem et kulstofatom og et iltatom (en C=O-binding). Nu er der to enkeltbindinger mellem kulstofatomet og de to andre iltatomer (to C-O-bindinger).
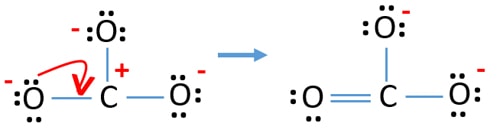
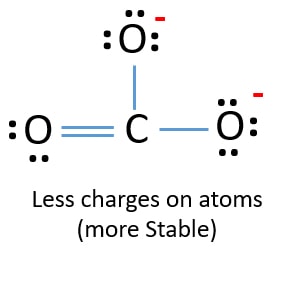
I den nye struktur er atomernes ladninger reduceret i forhold til den tidligere struktur. Nu er der ingen ladninger på det ene iltatom og på kulstofatomet. Desuden har kun to oxygenatomer -1 negative ladninger. Nu forstår du, at denne struktur af CO32- er mere stabil end den tidligere struktur. Så denne struktur har større chance for at være lewis-strukturen for CO32-ionen.
Lewis-struktur af CO32- (carbonat) ion
Spørgsmål
Sæt dine spørgsmål om kemi og find svarene
carbonat lewis-struktur og bikarbonat lewis-struktur
I carbonat-ionen er der to oxygenatomer, der har -1 ladning på hver af dem. Et af disse oxygenatomer tager en proton (H+-ion) og danner en -OH-gruppe.
Relaterede vejledninger
Skriv et svar