- Hvad er jern
- Hvor findes jern
- Historie
- Identifikation
- Klassifikation, Egenskaber og karakteristika for jern
- Generelle egenskaber
- Fysiske egenskaber
- Kemiske egenskaber
- Atomdata for jern (grundstof 26)
- Hvad er de almindelige anvendelser af jern
- Har grundstoffet nogen giftige virkninger
- Interessante fakta
- Jernmetalpris
Hvad er jern
Jern (udtalt som EYE-ren) er et hårdt metal med en høj kommerciel værdi, der tilhører familien af overgangsmetaller. Det er repræsenteret ved det kemiske symbol Fe og er kemisk reaktivt med en tendens til at korrodere let i luft og danner et rødligt lag kaldet rust, når det udsættes for fugtig luft .

Jernsymbol
Hvor findes jern
Det er det fjerde hyppigste metal i jordskorpen, der almindeligvis er forbundet med andre mineralske malme som hæmatit, taconit og magnetit, der findes i mineforekomster i Ukraine, Brasilien, Rusland, Australien og Kina. Den kommercielle produktion foregår i en højovn ved at opvarme malmene med koks og kalksten.
Historie
Origin af dets navn: Navnet på grundstoffet kommer fra et angelsaksisk ord ‘jern’.
Hvem opdagede det:
Hvor opdagede det: Ukendt
Hvornår, hvor og hvordan blev det opdaget
Omkring 3500 f.Kr. menes det, at egypterne brugte jerngenstande. Hittitterne fra Lilleasien var kendt for at smelte metallet fra dets malme i løbet af 1500 f.Kr. I 1722 udgav René Antoine Ferchault de Réaumur, en fransk entomolog, en bog, hvori han beskrev betydningen af forskellige jernlegeringer.

Jernmetal
Identifikation |
||||
| Atomatisk nummer | 26 | |||
| CAS-nummer | 7439-89-6 | |||
| Placering i det periodiske system | Gruppe | Gruppe | Periode | Blok |
| 8 | 4 | d | ||
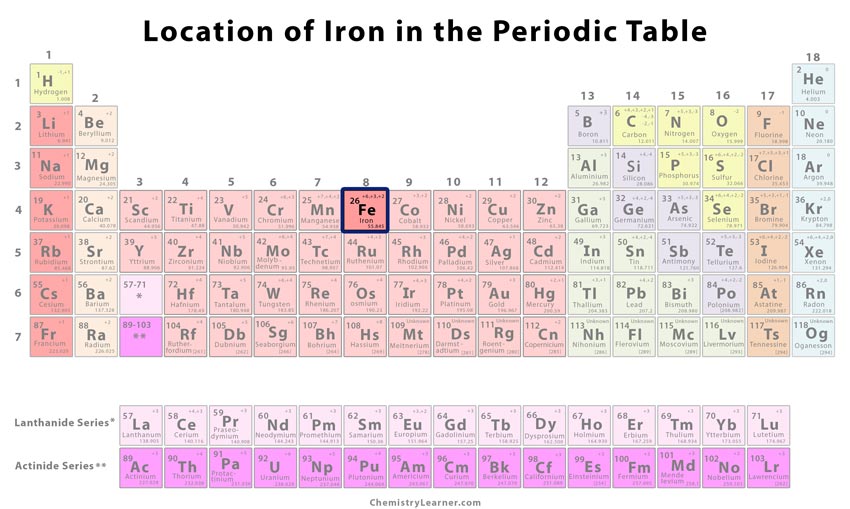
Hvor er jern i det periodiske system
Klassifikation, Egenskaber og karakteristika for jern
Generelle egenskaber |
||||
| Relativ atommasse | 55.845 | |||
| Atommasse/vægt | 55.845 atommasseenheder | |||
| Molarmasse/molekylvægt | 55.845 g/mol | |||
| Massetal | 56 | |||
Fysiske egenskaber |
||||
| Farve/fysisk udseende | Sølvgrå | |||
| Smeltepunkt/frysepunkt | 1538°C (2800°F) | |||
| Kogningspunkt | 2861°C (5182°F) | |||
| Densitet | 7.87 g/cm3 | |||
| Standard/naturlig tilstand ved stuetemperatur (fast/flydende/gas) | Fest | |||
| Mallebarhed | Ja | |||
| Duktilitet | Ja | |||
| Hårdhed | 4-5 Mohs | |||
| Specifik varmekapacitet | 0.444 J g-1 oC | |||
| Termoelektrisk ledningsevne | 80.4 Wm-1K-1 | |||
Kemiske egenskaber |
||||
| Brandfarlighed | Ikke brandfarlig | |||
| Oxidationstilstande (tal) | 6, 3, 2, 0,-2 | |||
Atomdata for jern (grundstof 26)
| Elektronkonfiguration (ædelgaskonfiguration) | 3d64s2 | ||||||
| Atomstruktur | |||||||
| – Antal elektroner | 26 | ||||||
| – Antal neutroner | 30 | ||||||
| – Antal af protoner | 26 | ||||||
| – Atomets radius | |||||||
| – Atomets radius | 2.04 Å | ||||||
| – Kovalent radius | 1.24 Å | ||||||
| Ioniseringsenergi
(kJmol-1) |
1. | 2. | 3. | 4. | 5. | 6. | 7. |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
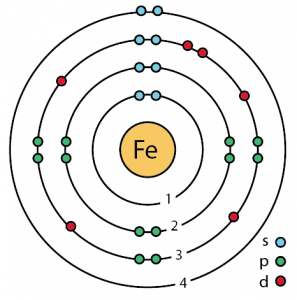
Ironets atomstruktur (Bohr-modellen)
Hvad er de almindelige anvendelser af jern
- Jern bruges til fremstilling af forskellige typer stål ved legering med andre grundstoffer som kulstof, nikkel, krom og wolfram til fremstilling af skæreudstyr, cykelkæder, geværløber, transmissionstårne, brobjælker og armeret beton .
- Rustfrit stål, der indeholder en høj procentdel jern sammen med andre metaller, har en enorm styrke og bedre funktion, der er nyttig til fremstilling af kirurgiske instrumenter, papirclips, bestik, kuglelejer og smykker .
- En anden form for Fe kaldet smedejern fremstillet ved smeltning anvendes til fremstilling af snedkerværktøj, løftekroge, kæder, hegn og porte .
- Jernfyldninger er anvendelige i elektromagnetiske videnskabelige eksperimenter til vurdering af magneters styrke samt i energimetallurgi, kunstværker, fyrværkeri og sandblæsning .
- Fe fungerer som en effektiv katalysator er nogle industrielle kemiske processer såsom Haber-processen og Fischer-Tropsch .

Jernstang
Har grundstoffet nogen giftige virkninger
En utilsigtet indtagelse af Fe har været forbundet med opkastning, diarré og andre gastrointestinale problemer, en almindelig form for metalforgiftning. Langvarig ophobning i kroppen kan resultere i åndedrætsbesvær og hjerteforstyrrelser . Indånding af metalstøv eller røg kan forårsage en alvorlig lungereaktion .
Interessante fakta
- Meteoritter menes at have et højt jernindhold .
- Jern blev brugt som et magnetisk metal af gamle navigatører i form af lodesten til fremstilling af kompasser .
- I en gennemsnitlig menneskekrop er der 4 gram Fe til stede, der er forbundet med hæmoglobin, som igen hjælper med at transportere ilt til lungerne .
-

Jernpulver
Jernmetalpris
Prisen på rent jern kan variere mellem 0,24 og 0,30 dollar pr. pund.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Skriv et svar