Resultater
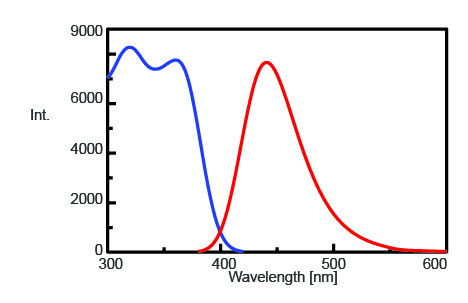
For at finde den maksimale emissionsbølgelængde til overvågning af fluorescensintensiteten af AMC efter trypsinkspaltning blev excitations- og emissionsspektret målt og er vist i figur 1. Den maksimale emissionsbølgelængde er fundet at være 440 nm.
For at standardisere den målte fluorescensintensitet af enzymopløsningen til koncentrationen af isoleret AMC blev der udført en titrering og målt fluorescens. 0,5 mL alikvater af en 50 µmol/L AMC-opløsning blev tilsat til en 2,5 mL enzymopløsning, og de indledende og endelige koncentrationer af isoleret AMC er opsummeret i tabel 1.
Tabel 1. Koncentrationer af isoleret AMC før og efter standardisering af fluorescensintensitet.
| Initialkoncentration | 3 | 6 | 15 | 30 | 60 | 120 | 240 |
| Slutkoncentration | 0.5 | 1 | 2,5 | 5 | 10 | 20 | 40 |
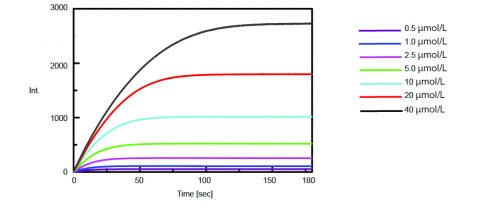
Den kinetik af trypsinaktiviteten blev derefter opnået ved at måle fluorescensintensiteten af isoleret AMC ved spaltning af trypsin fra substratet. Figur 2 viser tidsforløbsmålingerne efter at 0,5 mL af varierende koncentrationer af Boc-Gln-Ala-Arg-MCA-substratopløsningen blev tilsat til 2,5 mL af enzymopløsningen.
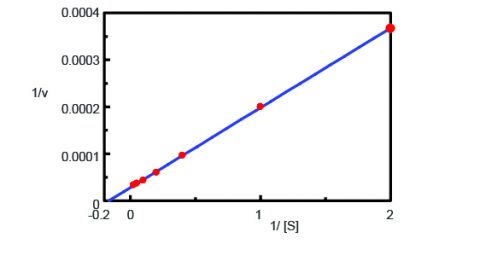
Ved hjælp af programmet Kinetics Analysis blev der tegnet en Lineweaver-Burk-graf (figur 3) ud fra fluorescenstidsforløbsmålingerne i figur 2. Lineweaver-Burk-plottet giver enzymkinetiske parametre som f.eks. den maksimale reaktionshastighed, Vmax, og Michaelis-Menten-konstanten, Km. Vmax beskriver reaktionshastigheden, når enzymet er mættet med substrat, mens Km angiver den mængde substrat, der skal til for at nå den maksimale reaktionshastighed. Vmax var 35,270 nmol/L-min-1 og Km var 5,99. Linjens ligning var 1/v = 1/v = 0,000270 – 1/ + 0,0000284.
Skriv et svar