Dipol – dipolkræfter
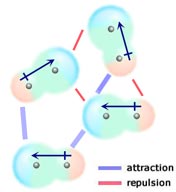
Hvis to neutrale molekyler, der hver har et permanent dipolmoment, mødes på en sådan måde, at deres modsat ladede ender flugter, vil de blive tiltrukket af hinanden. I en væske eller et fast stof favoriseres disse justeringer i forhold til dem, hvor de ens ladede ender af molekylerne er tæt på hinanden og derfor frastøder hinanden.
En af grundene til, at CH3F har et højere kogepunkt (-84 °C) end CF4 (-128 °C), er, at CF3H har et permanent dipolmoment, mens CF4 ikke har det. For at forstå dette fuldt ud skal man vide, at CF4 er tetraedrisk formet, og CH3F er nogenlunde tetraedrisk (der er ikke den store forskel på disse molekylers form). Kulstof-fluorbindingerne i begge molekyler er polære (fluor er meget mere elektronegativt end kulstof), men tilstedeværelsen af fire C-F-bindinger i det tetraedriske CF4-molekyle gør molekylet generelt upolært. Dipolmomentet fra den enkelte C-F-binding i CH3F ophæves ikke af C-H-bindingernes dipoler (som er meget små), så CH3F har et permanent dipolmoment.
En type af intermolekylær kraft, som kan opstå under særlige omstændigheder og normalt klassificeres som en dipol-dipolveksling, selv om den har en vis kovalent bindingskarakter, er hydrogenbinding.
Skriv et svar