Hvorfor er vand syre i reaktionen med ammoniak?
Dette er en god reaktion i almen kemi med vigtige konsekvenser for den organiske kemi. Et andet lignende spørgsmål er, hvorfor er vand en base, når det reagerer med en “syre”? Svaret på begge spørgsmål er: Det hele er relativt! Her på StudyOrgo får vi ofte spørgsmål som dette om emner i organisk kemi, som normalt er hurtigt dækket, dårligt beskrevet eller forventes at du kender fra tidligere kurser. Disse begreber er virkelig vigtige for at forstå de mere komplekse emner, der skal komme. Med et medlemskab af StudyOrgo får du endnu flere tips og tricks om emner inden for organisk kemi samt detaljerede mekanismer med forklaringer. Dagens blog er en forsmag på de detaljerede emner og materialer, der er tilgængelige. Tjek et medlemskab af StudyOrgo.com og tilmeld dig i dag!
Husk, at når det gælder syrer og baser, er der to definitioner; Bronsted- og Lewis-definitionen. Bronsted-syrer er defineret som protonedonorer, mens Lewis-syrer er defineret som elektronacceptorer. Begge er syrer, men det, vi tænker forskelligt på, er, om der er protoner eller elektroner involveret. I en vandig opløsning, almindelig kemi eller biokemi tænker vi primært på Bronsted-definitionen, fordi dissociation af protoner fra syrer ændrer opløsningskoncentrationen af H+, hvilket vi fortolker som en ændring i pH og opløsningens “surhedsgrad”. Vi måler dissociationen af protoner fra syrer eller accepten af protoner fra baser med en numerisk værdi, som er pKa. Jo større pKa, jo svagere er syren og jo stærkere er basen. Jo lavere pKa-værdien er, jo stærkere syre og svagere base. Et let trick til at tænke på pKa er at placere den protonerede version af molekylet til venstre og tænke på det som en protonedonor. PKa fortæller dig, hvor let denne donation vil være, jo lavere tal jo lettere er protonedonationen.
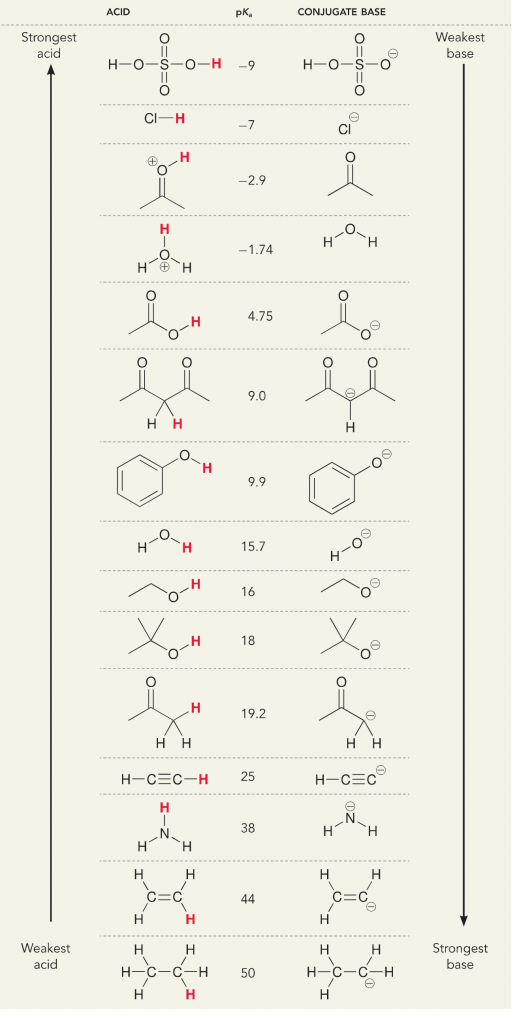
Lad os se på ammoniak og vandreaktionen; pKa for vand er defineret som 14. PKa for ammoniak er ~37.
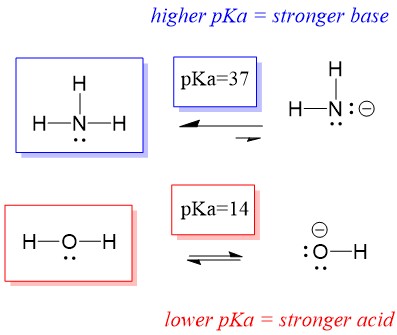
Derfor, fordi vands pKa er lavere end ammoniak, er det en stærkere syre end ammoniak og vil donere protoner til ammoniakbasen. Denne reaktion medfører, at vand bliver til den konjugerede base OH- og ammoniak bliver til den konjugerede syre NH4+. Interessant nok er dette grunden til, at ammoniak er et ætsende middel, det producerer hydroxid, der reagerer med pletter og mikroorganismer for effektivt at rense og desinficere husholdningsartikler.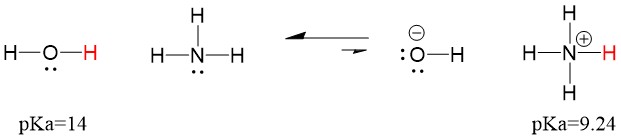
Dette er vigtigt som et begreb i organisk kemi, fordi styrken af syrer og baser i form af elektroner, eller Lewis-definitionen, er præcis sådan, som vi tænker på mekanismer for bindingsbrydning og bindingsdannelse; strømmen af elektroner. Styrken af Lewis-syrer og den konjugerede syre kan hjælpe med at identificere, i hvilken retning en reaktion vil forløbe. Vi kan se, at reaktionen af vand en ammoniak er ugunstig, men der sker nok af reaktionen i virkeligheden til at reducere vandets pH betydeligt (pH~11 med ammoniak).
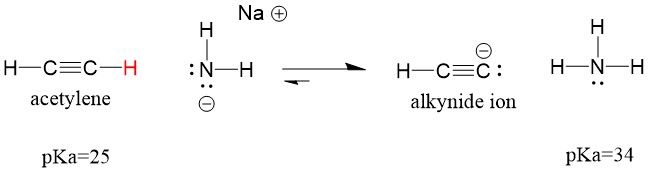
Lad os se på en acetylen, der reagerer med en base for at generere en alkynid-ion, en nyttig nukleofil for C-C-båndsdannelse. Hvis vi forsøger at lade natriumhydroxid reagere med alkyne, vil der IKKE blive dannet alkynidion. Dette skyldes, at det konjugerede syreprodukt af reaktionen er vand, som har en pKa på 15, er STÆRKERE end den oprindelige syre acetylen (pKa = 25). Reaktioner favoriserer ALTID dannelsen af den svagere syre, eller i dette tilfælde reaktantsiden.
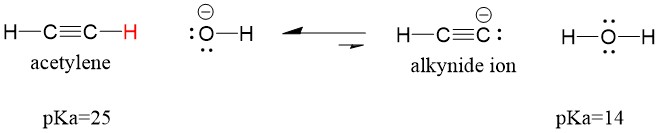
Hvis vi ændrer vores base til natriumamid, som er en meget stærkere base, VIL der dannes alkynidion. Dette skyldes, at reaktionens konjugerede syreprodukt er ammoniak, som har en pKa på 38, og som er en VÆRRE konjugeret syre end den oprindelige syre acetylen (pKa = 25). I dette tilfælde favoriserer reaktionen produktsiden!

Skriv et svar