Fra Proteopedia
proteopedia linkproteopedia link
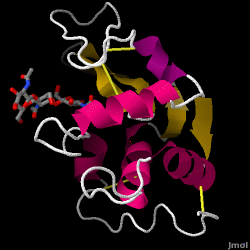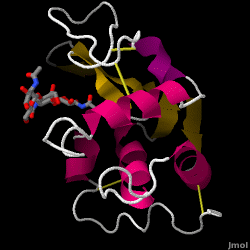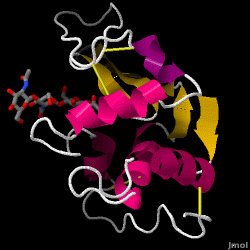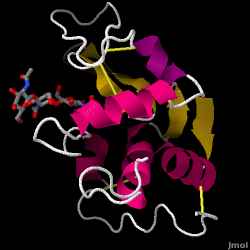
Lysozym – også kendt som muramidase – er et kraftigt enzym, der findes i rigelige mængder i tårer, spyt og modermælk. Hos mennesker er det kodet i LYZ-genet. Da det er et lille, let tilgængeligt og meget stabilt protein, har det været genstand for omfattende forskning vedrørende dets funktion og struktur.
Indledning
Lysozym fungerer som et uspecifikt forsvar mod bakterier og svampe. Det er en del af det medfødte immunsystem og er en vigtig del af et spædbarns kost for at afværge diarré. Det er et enzym, der er kendt for sin evne til at nedbryde polysaccharidarkitekturen i mange slags cellevægge, normalt med det formål at beskytte mod bakteriel infektion. Strukturen af lysozym fra hønseæggehvide (HEW), som er i fokus i denne artikel, er vist til højre. Den antibakterielle aktivitet af hønseæggehvide blev først beskrevet af Laschtschenko i 1909. Den blev karakteriseret og navngivet “lysozym” af Alexander Fleming, den samme person, der blev krediteret for opdagelsen af penicillin. Opdagelsen af den enzymatiske aktivitet skete ved et uheld; under det ikke-relaterede forsøg blev der ved et uheld bragt næsedråber ind i en petriskål med en bakteriekultur, og denne kultur viste følgelig resultaterne af en endnu ukendt enzymatisk reaktion. Observationen af denne ukendte reaktion førte til yderligere forskning i komponenterne i denne reaktion og til den tilsvarende identifikation af det nyfundne “lysozym”. I 1965 bestemte David C. Phillips og medarbejdere den tredimensionelle struktur af lysozym med en opløsning på 2 Å . Phillips’ arbejde var især banebrydende, da det var lykkedes Phillips at opklare strukturen af et enzym ved hjælp af røntgenkrystallografi – en bedrift, som aldrig tidligere var lykkedes. Phillips’ forskning førte også til en strukturbaseret hypotese om dets virkningsmekanisme.
Funktion
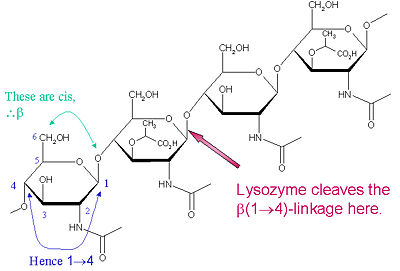
Det særlige substrat, der foretrækkes for denne spaltningstype, er et (NAG-NAM)₃ hexasaccharid, inden for hvilket substrat forekommer den spaltede målglykosidbinding, NAM₄-β-O-NAG₅. De enkelte hexasaccharidbindingsenheder er betegnet A-F, med NAM₄-β-O-NAG₅ glykosidbindingsspaltningspræference svarende til en D-E-enhed glykosidbinding cl
Lysozym er kendt for at skade bakterielle cellevægge ved at katalysere hydrolysen af 1,4-beta-bindinger mellem N-acetylmuraminsyre (NAM) og N-acetyl-D-glucosaminrester (NAG) i peptidoglykan og mellem N-acetyl-D-glucosaminrester i chitodextriner. På denne måde er lysozym effektivt til at lysere cellevæggene hos både bakterier og svampe. Lysozymets spaltningssted på dette arkitektoniske tema er den β(1-4)-glykosidiske binding, der forbinder C1-kulstoffet i NAM med C4-kulstoffet i NAG.
Det særlige substrat, der foretrækkes for denne spaltningstype, er et (NAG-NAM)₃ hexasaccharid, inden for hvilket substrat forekommer den spaltede målglykosidbinding, NAM₄-β-O-NAG₅. De enkelte hexasaccharidbindingsenheder er betegnet A-F, med NAM₄-β-O-NAG₅ glykosidbindingsspaltningspræference svarende til en D-E-enheds glykosidbindingsspaltningspræference. Afhængigt af den organisme, hvorfra lysozym er fremstillet, foregår hydrolysen af den glykosidiske binding med bevarelse af konfigurationen ved det anomeriske kulstof (hønseæggehvide) eller med inversion (gås, fage T4).
Lysozym virker effektivt på lange (NAG-NAM) eller (NAG)-polymerer. Når kædelængden bliver mindre end seks monomerer, falder de katalytiske hastigheder betydeligt; faktisk virker trisaccharider som konkurrerende inhibitorer ved at binde sig til det aktive sted i et ikke-produktivt register.
Hen æggehvide lysozym (PDB-kode 1hew)
Mekanisme
Hønseæggehvide lysozym’s hydrolyse af glykosidbindinger foregår med bibeholdelse af konfiguration. I 1953 foreslog Koshland, at bevarelse af konfiguration generelt indebærer en mekanisme med dobbelt forskydning (mens inversion af konfiguration indebærer enkelt forskydning). I årtier har man overvejet to konkurrerende mekanistiske hypoteser (Phillips: dissociativ mekanisme med oxocarbeniumintermediær; Koshland: totrinsassociativ mekanisme med kovalent enzymkompleks som mellemprodukt), men data fra 2001 har fået vægten til at tippe i retning af, at der findes et kovalent mellemprodukt. Fraværet af en substratkompleksstruktur bidrog helt sikkert til vanskelighederne med at skelne mellem mulige mekanismer, ligesom eksistensen af to forskellige mekanismer (retention og inversion af konfiguration) inden for den samme strukturelle familie af enzymer (f.eks. høne vs. gåseenzym).
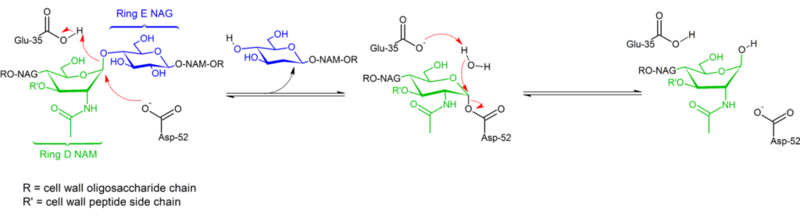
Lysozym hydrolyserer et glykosid (deraf den familiære klassifikation af lysozym som en glykosylase), hvilket svarer til omdannelsen af et acetal til et hemiacetal. Reaktionen forløber i to trin som vist i figuren ovenfor. I det første trin fungerer Asp 52 som nukleofil, og en del af sukkeret er den udgående gruppe. I andet trin fungerer vand som nukleofil, og Asp 52 fungerer som afgangsgruppe. Begge trin inverterer konfigurationen ved det anomeriske kulstof, hvilket fører til en samlet bevarelse af konfigurationen. Glu 35 virker som en syre i første trin (protonering af sukkeret i den glykosidiske binding for at gøre det til en bedre elektrofil) og som en base i andet trin (deprotonering af vand for at gøre det til en bedre nukleofil). Mens figuren viser nogle af sukkerstofferne i en bådkonformation for at understrege inversionen af konfigurationen, er disse ikke observeret eksperimentelt, men findes snarere i en stolekonformation.
Anvendelser af lysozym
Da lysozym er blevet bredt anerkendt for sine antibakterielle og svampedræbende egenskaber, har det en lang række anvendelsesmuligheder både inden for biokemiske og farmaceutiske anvendelser. Inden for molekylærbiologi anvendes lysozym ofte i den alkaliske analyseprocedure til ekstraktion og isolering af plasmid-DNA. Det anvendes i vid udstrækning på lægemiddelområdet til at ødelægge grampositive bakterier og kan anvendes til at støtte allerede eksisterende immunforsvar til at bekæmpe bakterieinfektioner. Dette enzym er især vigtigt for at forebygge bakterielle sygdomme hos spædbørn. På grund af dets antibakterielle egenskaber kan lysozym også anvendes i fødevareindustrien til at forhindre fordærv af fødevarer.
Se også
- Lysozym 3D-strukturer
- Lysozym
- Tilbageholdende glykosidhydrolaser
- Molekylær legeplads/Lysozym
- Bruger:Judy Voet/Lysozym
- Lysozym (arabisk)
- Lysozym (hebraisk)
- Ragland SA, Criss AK. Fra bakteriedrab til immunmodulation: Nyere indsigt i lysozymets funktioner. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) Om et bemærkelsesværdigt bakteriolytisk element fundet i væv og sekreter. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Strukturen af lysozym fra hønseæggehvide. En tredimensionel Fourier-syntese med en opløsning på 2 Angstrom. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. En introduktion til enzym- og koenzymkemi. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Krystallografiske undersøgelser af aktiviteten af lysozym fra hønseæggehvide. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Billede fra: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Tidlige båndtegninger af proteiner. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Strukturen af lysozym fra hønseæggehvide. En tredimensionel Fourier-syntese med en opløsning på 2 Angstrom. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Struktur af nogle krystallinske lysozym-inhibitor-komplekser bestemt ved røntgenanalyse ved 6 Angstrom-opløsning. Nature. 1965 May 22;206(986);206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Davies GJ, Laine R, Withers SG. Katalysen ved hønseæggehvide lysozym foregår via et kovalent mellemprodukt. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers og Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia Page Contributors and Editors (hvad er det her?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
Hentet fra “http://proteopedia.org/wiki/index.php/Hen_Egg-White_%28HEW%29_Lysozyme”
Proteopedia Page Contributors and Editors (hvad er det her?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
Skriv et svar