- Introduktion
- Eksperimentelt
- Materialer
- Syntese af interkalationsforbindelser
- Karakterisering
- Resultater og diskussion
- XRD-karakterisering
- FTIR-spektre
- Strukturel model for Kaol/alkylamin-interkalationsforbindelser
- Thermisk analyse
- Decompositionsreaktionskinetik
- Konklusioner
- Author Contributions
- Interessekonflikter
- Akkreditering
Introduktion
Design og fremstilling af ler/polymer nanokompositter har tiltrukket stor interesse fra både det videnskabelige og tekniske samfund (Cheng et al., 2017). En lang række ler/polymer-nanokompositter er blevet udviklet og anvendes i vidt udbredt anvendelse (Gogoi og Raidongia, 2017). Præinterkalering af ler efterfulgt af inkorporering af polymerer i lerminerallaget er en bredt anvendt tilgang til fremstilling af ler/polymer-nanokompositter (Li et al., 2009; Zare et al., 2017). Mens de er interkaleret i uorganiske lerlag, reducerer organiske polymerkæder naturligt deres strukturelle mobilitet, og nogle af dem antager en meget organiseret konformation inden for lagstrukturen.
I naturen er kaolinit (Kaol) en type lermineral med en 1:1 dioctaedrisk aluminiumsilikatlagstruktur (Brindley og Robinson, 1945). Lagene i Kaol holdes sammen af hydrogenbindinger, dipol-dipol-interaktioner og van der Waals-kræfter (Brindley et al., 1967). Det er imidlertid kun lykkedes at interkalere et begrænset antal meget polære organiske arter, herunder urinstof (Makó et al., 2009), dimethylsulfoxid (Costanzo og Giesse, 1986), formamid (Frost et al., 2000a), hydrazin (Cruz og Franco, 2000) og kaliumacetat (Frost et al., 2000b), i Kaol’s galleri. Interkalering af små molekyler i Kaol-lagene forårsager en forøgelse af basalafstanden og kan bruges som et indledende ekspansionstrin for efterfølgende indsættelse af store, ikke-reaktive arter af stor størrelse ved fortrængning af de præinterkalerede små molekyler (Cheng et al., 2015). For eksempel kan en Kaol/methanol-interkalationsforbindelse baseret på de tidligere rapporter være et effektivt mellemprodukt for yderligere interkalationsreaktion med ethylenglycol (Hirsemann et al., 2011), hexylamin (Matusik et al., 2012), n-alkylaminer (Gardolinski og Lagaly, 2005) og kvaternære ammoniumsalte (Cheng et al., 2016). Desuden er de fleste gæstemolekyler vanskelige at blive indsat i mellemlagrummet, en af grundene er de stærke hydrogenbindinger, en anden er, at der ikke er nogen udskiftelige ioner i Kaol-strukturen.
Selv om ler/polymer-nanokompositter er blevet godt udviklet i de seneste år, udgør det stadig en stor udfordring at syntetisere nye ler/organiske nanokompositter til potentiel anvendelse (Kotal og Bhowmick, 2015). For at løse dette problem er det virkelig et presserende anliggende at finde ud af nanoskala-processen for kaolinitinterkalation og foretage en grundig undersøgelse af nedbrydningsmekanismen med moderne teknologi og analytiske værktøjer. Termisk analyse og kinetisk beregning af ler/polymer interkalationsforbindelser kan hjælpe med at karakterisere nedbrydningsprocesserne og give videnskabeligt grundlag for kontrol af interkalationsreaktioner (Zhang et al., 2015). De kinetiske parametre for nedbrydningsreaktionens kinetiske proces, såsom aktiveringsenergi, præeksponentiel, reaktionsordner og hastighedskonstant, blev vurderet med data fra ler/polymer termogrammer. I denne undersøgelse blev interkalationen af Kaol med forskellige alkylaminer undersøgt. Desuden blev interkalationsprocessen og nedbrydningsmekanismen systematisk undersøgt.
Eksperimentelt
Materialer
Kaolin, der blev anvendt i denne undersøgelse, blev udnyttet fra Zhangjiakou, Kina. Den vigtigste mineralsammensætning er en velordnet kaolinit (95 % i masse). Det blev malet til at passere en 325-mesh sigte (partikler, der måler < 44 μm) før interkalering. Alkylaminhexylamin (HA, 99 %), dodecylamin (DA, kemisk ren) og octadecylamin (OA, kemisk ren) blev købt fra Nanjing Shuguang Chemical Company, Kina. Dimethylsulfoxid (DMSO, analytisk reagens), methanol (MeOH, analytisk reagens) og toluen (99 %) blev modtaget fra Xilong Chemical Company, Kina, og blev anvendt som modtaget uden yderligere rensning. Den kemiske formel og strukturformlen for HA, DA og OA er vist i tabel 1.

Tabel 1. Kemisk og strukturel formel for HA, DA og OA.
Syntese af interkalationsforbindelser
Først blev Kaol/DMSO-interkalationsforbindelse fremstillet ved at dispergere 20,0 g Kaol i en blanding af 36,0 g DMSO og 4,0 g vand. Blandingen blev omrørt i et vandbad i 2 timer ved 95 °C, og derefter blev suspensionen separeret ved centrifugering med ethanol. For det andet blev Kaol/DMSO-interkalationsforbindelsen anvendt som en forløber til yderligere reaktion med MeOH. MeOH blev tilsat til den præinterkalerede Kaol, og reaktionsblandingen blev omrørt i 10 dage, idet MeOH blev udskiftet hver dag med en tilsvarende mængde frisk MeOH. Udfældningen i blandingen blev separeret ved centrifugering og tørret i en ovn ved 60 °C i 12 timer for at opnå interkalationsforbindelser af Kaol/MeOH. Endelig blev 2 g Kaol/MeOH-interkalationsforbindelse blandet med henholdsvis 30,0 mL HA-, DA- eller OA-methanolopløsninger (1 mol/L) under omrøring ved stuetemperatur. Dispersionerne blev centrifugeret efter reaktion i 24 timer. Sedimenterne blev vasket tre gange med toluen for at fjerne det overskydende HA, DA eller OA. Prøverne blev tørret ved stuetemperatur i 12 timer og formalet til pulver med en agatmorter (Komori et al., 1999). De resulterende forbindelser er mærket som Kaolpi/HA (pi som præinterkaleret), Kaolpi/DA og Kaolpi/OA.
Karakterisering
XRD-mønstrene blev optaget på et Rigaku D/max 2500PC røntgendiffraktometer med Cu Kα-stråling (λ = 1,54178 Å), der arbejder ved 40 kV og 150 mA. De tilfældigt orienterede prøveeksemplarer blev scannet i 2θ-området mellem 1 og 20° ved en hastighed på 2° min-1. Et Thermo Fisher Nicolet 6700 spektrofotometer blev brugt til at registrere FTIR-spektre inden for området 4.000~400 cm-1. TG-DSC-analyserne blev udført med en Mettler-Toledo TG-DSC I/1600 HT simultane termiske analysator under nitrogenatmosfære. Tyve milligram prøve blev anbragt i en aluminiumoxiddigel og opvarmet fra 30 til 1.100°C med en række opvarmningshastigheder på 4, 6, 8, 10°C min-1.
Resultater og diskussion
XRD-karakterisering
XRD-mønstrene for den uberørte Kaol og dens interkalationsforbindelser er vist i figur 1. Mønsteret af den uberørte Kaol viser en velordnet lagdelt struktur med en basalafstand på 0,71 nm. Denne værdi stemmer godt overens med ICDD’s standardreferencemønster 14-0164 . Ved behandling med DMSO opstod der et nyt basalreflektionstæppe ved 1,14 nm, hvilket viser, at det lykkedes at indsætte DMSO i Kaol-folier. Efter at Kaol/DMSO-interkalationsforbindelsen var blevet behandlet med MeOH, blev Kaol/DMSO-interkalationsforbindelsens 1,14 nm (001)-reflektionskarakteristik forskudt til 0,86 nm. Det blev rapporteret af Matusik et al. (2012), at Kaol/DMSO/MeOH-forbindelsen blev tørret ved 110 °C, og at refleksionen med d = 1,12 nm forsvandt, og der blev observeret en bred refleksion med maksimum ved 0,95 nm. Baseret på den kemiske formel Al2Si2O5(OH)3.20(OCH3)0.80 for Kaol/DMSO-interkalationsforbindelsen, som er blevet beregnet i henhold til grundlaget for CHNS analyse, viste det, at omkring 1/3 af de indre overflade OH grupper blev erstattet af methoxygrupper, og denne observation tyder også på dannelsen af en Kaol/MeOH interkalationsforbindelse (Tunney og Detellier, 1996; Cheng et al., 2015). XRD-mønstrene viser også, at Kaol/MeOH-forbindelserne interkaleret med HA, DA og OA udvider strukturen langs c-aksen, hvilket fører til en stor mellemlagsafstand på henholdsvis 2,86, 4,08 og 5,66 nm. Længden af HA-, DA- og OA-molekylkæderne er henholdsvis 1,56, 2,51 og 3,65 nm (McNulty et al., 2011, 2014). Samlet set øgedes mellemlagsafstanden mellem Kaol/alkylamininterkalationsforbindelserne med alkylkædelængden af alkylaminerne, men alkylaminmolekylet er ikke en enkeltlags- eller dobbeltlagsstruktur, der er vinkelret på Kaol-overfladen.
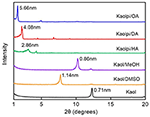
Figur 1. XRD-mønstre af Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA og Kaolpi/OA.
FTIR-spektre
FTIR-spektroskopi er blevet anvendt i vid udstrækning til karakterisering af interkalationsforbindelser (Ledoux og White, 1964; Frost et al., 2000c; Cheng et al., 2012). FTIR-spektre af de originale Kaol-, Kaolpi/HA-, Kaolpi/DA- og Kaolpi/OA-interkalationsforbindelser er vist i figur 2. De karakteristiske bånd ved 432, 470 og 541 cm-1 (figur 2B) tilhører deformationsmoduserne for Si-O, Si-O-Si og Al-O-Si. De andre bånd ved 1 009, 1 031 og 1 114 cm-1 (figur 2C) er tildelt strækningsvibrationerne for Si-O-Si i Kaol-laget. Ved sammenligning af spektrene for Kaol og dets interkalationsforbindelser har bandernes position ingen tydelig variation, hvilket tyder på, at disse strækningsvibrationsbånd ikke påvirkes af de interkalerede molekyler.
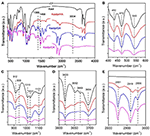
Figur 2. Infrarøde spektrer af Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Båndene ved 912 og 938 cm-1 (figur 2C) tilhører OH-deformationen af de indre hydroxylgrupper og hydroxylgrupper på den indre overflade. Der er fire tydelige hydroxylstrækningsbånd ved 3,694, 3,669, 3,652 og 3,620 cm-1 (figur 2D) i spektret af den originale Kaol, båndene ved 3,694, 3,669 og 3,652 cm-1 skyldes hydroxylgrupperne på den indre overflade, mens det ved 3,620 cm-1 skyldes de indre hydroxylgrupper (Farmer, 1964; Ledoux og White, 1964; Giese og Datta, 1973). Efter indlejringen af alkylaminmolekyler blev nogle bånd svækket som følge af ændringen af interaktionerne med naboatomer. Forskydningen til 3,697 cm-1 og faldet i intensiteten af båndet ved 3,694 cm-1 indikerer, at mange hydroxylgrupper i Kaol deltog og dannede hydrogenbindinger med amingrupperne i alkylaminmolekylerne (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
Anstedeværelsen af alkylaminmolekyler mellem lagene blev påvist på FTIR-spektret ved de nye peaks, som er vist i figur 2A,E. For interkalationsforbindelserne tilhører nogle tydelige karakteristiske toppe som f.eks. båndet ved 1 388 og 1 468 cm-1 C-H-bøjningstilstanden for henholdsvis -CH3 og -CH2. Der blev observeret et nyt vibrationsbånd ved 3.334 cm-1 , som skyldes strækningsmodus af N-H-strækningsvibrationen (Griffiths og De Haseth, 2007; Zhang et al., 2018). Det nye vibrationsbånd ved 2,956 cm-1 blev observeret og blev normalt tildelt C-H asymmetrisk strækningsbånd af de terminale methylgrupper (Cheng et al., 2016). De to vibrationsbånd ved 2,919 og 2,851 cm-1 tildeles normalt til de symmetriske og asymmetriske strækningsvibrationer af -(CH2)n- (Venkataraman og Vasudevan, 2001). Intensiteten af båndene stiger gradvist, hvilket betyder, at der er blevet indsat flere alkylamin-kulstofatomer i Kaol-folier. Desuden vil alkylaminernes flygtighed falde med stigningen i kulstofkæden, så stabiliteten af de tilsvarende Kaol-interkalationsforbindelser vil gradvist stige med større alkylaminmolekylmasse (Wang et al., 2010).
Strukturel model for Kaol/alkylamin-interkalationsforbindelser
Anordningen af interkalerede molekyler er grundlaget for den eksperimentelle analyse af Kaol/alkylamin-interkalationsforbindelsernes struktur. Ifølge Lagaly (1981) kan strukturmodellerne for montmorillonit-kvaternære ammoniumsalteinterkalationsforbindelser opdeles i tre kategorier: (a) monolag: kortkædede alkylaminioner; (b) bilag: langkædede kvaternære ammoniumioner; (c) tre lag: knækkede alkylkæder i højt ladede lermineraler. Beneke og Lagaly (1982) foreslog endvidere forskellige strukturer af de interkalerede alkylaminmolekyler baseret på XRD, som er opsummeret som følger: (a) alkylkæderne i mellemlagrummet er skråt til (001)-krystalplanet; (b) alkylkæderne er anbragt i to lag. Brindley og Moll (1965) beskrev, at de interkalerede molekyler hælder mod silikatpladerne i et enkelt lag, mens vinklen er ca. 65° mod (001) krystalplanet. Hvis de interagerende molekyler er ensartet fastgjort til alle silikatoverflader med de aktive hydroxylgrupper, foreslås en “end to end” organisation i par med en vis langsgående forskydning. Hældningsvinklen er i overensstemmelse med den mulige tætte pakningsmåde mellem silikatets iltoverflader og de terminale hydroxylgrupper og graden af tæt pakning af kædemolekylerne indbyrdes.
Alkylmolekylerne er svære at interkalere direkte i de oprindelige Kaol-lag, da der mangler udskiftelige ioner i Kaol’s mellemlagsområde. Gyldige prækursorer er afgørende, når alkylaminmolekylerne indsættes i mellemlagene af Kaol. Det er blevet rapporteret, at alkyltrimethylammoniumchloridkæden danner et skråt dobbeltlag i Kaol’s mellemlag, og skråvinklen er ~36° efter beregning (Kuroda et al., 2011). Yuan et al. (2013) påpegede, at det strukturelle arrangement af de kvaternære ammoniumsaltmolekyler i det mellemliggende lag af Kaol er et tippet dobbeltlag, og at hældningsvinklen er ~38,4°. Gardolinski og Lagaly (2005) foreslog, at alkylkæderne i mellemlagene er fuldt udstrakt og orienteret vinkelret på Kaol-overfladen af bilaget. Derfor kan man ud fra en analyse af længden af HA-, DA- og OA-molekylkæderne konkludere, at den basale afstand efter interkalation ikke er tilstrækkelig til, at alkylkæden kan trænge ind på lodret og dobbeltlagsmæssig vis. En yderligere analyse af XRD-resultaterne viser, at alkylkæderne af HA, DA og OA hælder mod Kaol-overfladen i to lag, og at alkylekædernes hældningsvinkel er henholdsvis ca. 39,9, 39,9 og 41,1°. På grund af hydroxylbindingen mellem hydroxyl i Kaol på den indre overflade og amingrupper i alkylaminmolekylerne er den mest mulige strukturmodel for Kaol/alkylamin-interkalationsforbindelserne desuden vist i figur 3.
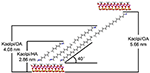
Figur 3. Den mest mulige strukturmodel for interkalationsforbindelserne af kaolinit/alkylamin.
Thermisk analyse
TG-DSC-analyseresultaterne for Kaol og dets interkalationsforbindelser er vist i figur 4. Det største massetab af Kaol er det mellem 400 og 600 °C med den maksimale tabsrate ved 525 °C, der tilskrives tabet af vand på grund af dehydroxylering af krystalgitteret, hvilket resulterer i dannelsen af meta-kaolinit (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Dette tab svarer til ca. 12,7 % af den samlede masse, hvilket er meget tæt på den teoretiske reference (13,9 %). Ved sammenligning af TG-DSC-kurverne for den originale Kaol observeres to hovedtrapper for massetab i Kaolpi/HA-, Kaolpi/DA- og Kaolpi/OA-interkalationsforbindelserne. Det første trin fandt sted mellem 150 og 350 °C, hvilket skyldes nedbrydningen af de interkalerede alkylaminmolekyler (Yuan et al., 2013). Den anden opstod ved ca. 500 °C og skyldes dehydroxylering af den deinterkalerede Kaol. For Kaolpi/OA blev noget OA interkaleret ind i silikatmellemlaget for at danne en stabil interkalation, hvilket kan bevises ved XRD-mønsteret. Nogle molekyler er viklet ind i hinanden på grund af den lange kæde eller en klemme i nanorullerne, som ikke kan fjernes helt (Li et al., 2015; Liu et al., 2016). Ved 220 °C skyldes det tydelige massetab nedbrydningen af den coatede eller ubundne OA, mens massetabet ved 330 °C tilskrives nedbrydningen af interkaleret OA. Det eksoterme peak ved 996°C er resultat af omkrystallisering af Kaol.
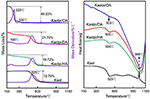
Figur 4. TG-DSC-kurver for Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Ved sammenligning af TG-DSC-kurverne for de originale Kaol- og Kaol/alkylamin-interkalationsforbindelser (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA) kan man konstatere: (a) den har forskellige massetabstrin, samt en betydelig forskel i massetab mellem Kaolpi/OA og de to andre interkalationsforbindelser (Kaolpi/HA, Kaolpi/DA). Massetabet for nedbrydningen af Kaolpi/HA og Kaolpi/DA var ca. 20 %, men mængden af de to massetab for Kaolpi/OA er ca. 50 %. Dette kan skyldes, at en større mængde OA blev interkaleret ind i silikatmellemlaget rummet end HA og DA (Wang et al., 2017). (b) Dehydroxyleringstemperaturen for interkalationsforbindelserne var lavere end for den oprindelige Kaol med ca. 20 °C. Dette skyldes, at interkalationsmolekylerne udvidede mellemlagsafstanden, svækkede hydrogenbindingerne mellem Kaol-lagene, hvilket medførte en lettere dehydroxylering fra Kaol-overfladen. Derfor faldt Kaol’s krystallinitet kraftigt efter interkalation, hvilket kan bekræftes ved XRD og IR (under 800 cm-1). Dette resultat er i overensstemmelse med konklusionen i nogle andre rapporter om, at temperaturen for dehydroxylering blev bestemt af Kaols krystallinitet (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Decompositionsreaktionskinetik
Den nedbrydningskinetik af Kaol/alkylamin-interkalationsforbindelsen blev undersøgt ved hjælp af termogravimetriske teknikker. De kinetiske parametre (aktiveringsenergien E og den præekponentielle faktor A) for nedbrydningsprocessen blev beregnet på grundlag af KAS- og Ozawa-metoderne (Kissinger, 1957; Škvára og Šesták, 1975). Den termiske nedbrydningsmekanisme for Kaol/alkylamin-interkalationsforbindelsen blev undersøgt med Satava-integritetsmetoden (Xie et al., 2001; Gao et al., 2005; Zhang et al., 2015).
I henhold til reaktionsteorien udtrykkes den ikke-isoterme nedbrydningskinetiske formel normalt som følger:
hvor α er omfanget af omdannelseshastigheden af B(s) på tidspunktet t, f (α) er reaktionsmekanismefunktionen, og k er reaktionshastighedskonstanten. k adlyder følgende ligning:
Hvis prøvens temperatur styres med en konstant opvarmningshastighed (β = dT/dt), kan reaktionshastigheden defineres som følger:
Efter adskillelse af variablen, omlægning med integral- eller differentialefunktioner af ligning (4), kan KAS-ligning (5) og Ozawa-ligning (6) beregnes som følger:
Hvor G(α) repræsenterer den integrale funktion af omregning. På grund af den integrale tilnærmelse blev der anvendt iterative metoder til at beregne E for at undgå visse afvigelser. Funktionerne i iterative metoder er som følger:
Sæt x = E/RT, så er definitionen af h(x) og H(x):
Iterationen er som følgende tre trin:
(a) Indstil h(x) = 1 eller H(x) = 1, beregn E0 ved hjælp af mindste kvadraters metode i overensstemmelse med hældningen af den lineære sammenhæng lnβ/T2 og lnβ til 1/T.
(c) Udskift E0 med E1, gentag trin (b), indtil Ei-Ei-1 < 0. 1 kJ mol-1. Ei er den nøjagtige værdi af aktiveringsenergien for nedbrydningsreaktionen.
E-værdierne for Kaol/alkylamin-interkalationsforbindelser blev beregnet ved hjælp af KAS-, Ozawa- og iterative metoder (tabel 2). De beregnede resultater, der blev opnået ved KAS-metoden, lå tættere på resultaterne fra iterative metoder, men resultaterne fra den iterative Ozawa-metode viste større afvigelse i forhold til andre. Derfor kan den gennemsnitlige E fra iterative metoder betragtes som aktiveringsenergien for nedbrydningsreaktionen, da de er en forbedring i forhold til KAS- og Ozawa-metoderne. Den gennemsnitlige E for Kaolpi/HA, Kaolpi/DA og Kaolpi/OA er 104,44, 130,80 og 154,59 kJ mol-1. Det kan ses, at den gennemsnitlige E blandt Kaol/alkylaminforbindelser har en positiv korrelation med alkylkædens længde. En af grundene hertil er, at flygtigheden svækkes, når alkylkæden vokser. En anden grund er, at Kaolpi/OA har den bedst velordnede interkalationsstruktur, som er vanskeligst at de-interkalere. Og disse resultater kan bekræftes af XRD-mønstre.
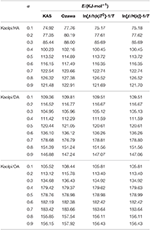
Tabel 2. E af Kaol/alkylamin-interkalationsforbindelser med forskellige α beregnet ved KAS-, Ozawa- og iterationsmetoder.
Funktionerne og A for nedbrydningsreaktionsmekanismen blev beregnet ved Satava-metoder, som blev beskrevet som følger:
Substituere α i hver mekanismefunktion G(α) for at opnå værdien af lg, lineær tilpasning lg og 1/T, som svarer til opvarmningshastigheden, den funktion, som har den største tilpasning, kan bestemmes som den mest sandsynlige mekanismefunktion. Og værdierne af E og A kan fås ved hjælp af hældningen og interceptet af en lineær tilpasningskurve.
Som det fremgår af tabel 3, vælges fem mekanismefunktioner med en tilpasningsevne på over 90 % på grundlag af Satava-integritetsformlen. Ved at sammenligne de fem funktioner kan mekanismefunktion nr. 9 G(α) = 2 med en tilpasningsevne på ca. 97 % betragtes som den mest sandsynlige mekanismefunktion, og de lineære tilpasningskurver for funktion nr. 9 er vist i figur 5. E og A ligger også i det normale område for nedbrydningskinetikken. Nedbrydningsmekanismefunktionerne for de tre Kaol/alkylamin-interkalationsforbindelser er angivet i tabel 4.

Tabel 3. Udvalgte kinetiske mekanismefunktioner bedømt ved Satava-integralmetoden.

Figur 5. Lineære tilpasningskurver for nr. 9-funktionen bedømt ved Satava-integralmetoden.

Tabel 4

Tabel 4. Kinetiske mekanismefunktioner for Kaol/alkylamin-interkalationsforbindelser.
Konklusioner
De mulige strukturmodeller og nedbrydningskinetikken for Kaol/alkylamin-interkalationsforbindelser er blevet undersøgt ved hjælp af XRD, FT-IR og TG-DSC. Interkalation af Kaol/MeOH-forbindelse med HA, DA og OA udvider Kaols mellemlagsafstand langs c-aksen, hvilket resulterer i den dominerende refleksion, der optræder ved henholdsvis 2,86, 4,08 og 5,66 nm. Desuden er basalafstanden efter interkalering ikke tilstrækkelig til, at alky-kæden kan trænge ind på lodret enkelt- og dobbeltlagsmåde. Det blev konkluderet, at alky-kæderne af HA, DA og OA hælder til Kaol-overfladen i to lag, og alky-kædernes hældningsvinkel er ~40°.
Baseret på KAS-, Ozawa- og iterative metoder blev resultaterne af aktiveringsenergien E for Kaol/alkylamin-interkalationsforbindelser beregnet. Den gennemsnitlige aktiveringsenergi E for Kaolpi/HA, Kaolpi/DA og Kaolpi/OA er 104,44, 130,80 og 154,59 kJ mol-1. Den gennemsnitlige aktiveringsenergi E blandt Kaol/alkylaminforbindelser har en positiv korrelation med alkylkædens længde. Den optimerede mekanismefunktion for Kaol/alkylamin-nedbrydningsprocessen blev bestemt som en 3D-diffusion med integralfunktionen G(α) = 2. Denne forskning er fordelagtig for bedre at forstå nedbrydningsmekanismen for ler/organiske nanokompositter ud over at give inspiration til at syntetisere nye lerbaserede materialer.
Author Contributions
HC og QfL designede eksperimentet og reviderede papiret. YZ, QhL og PX udførte eksperimenterne og skrev papiret. YZ og QhL bidrog ligeligt til dette arbejde.
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Dr. Luyi Sun (Department of Chemical and Biomolecular Engineering and Polymer Program, Institute of Materials Science, University of Connecticut) takkes for at have revideret papiret. Forfatterne takker for den finansielle støtte fra National Natural Science Foundation of China (41602171), Beijing Natural Science Foundation (8164062) og Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing.
Giese, R., og Datta, P. (1973). Hydroxylorientering i kaolinit, dickit og nacrit. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., og De Haseth, J. A. (2007). Fouriertransform-infrarødspektrometri. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., og Guggenheim, S. (1985). Dehydroxylering af kaolinit. Am. Mineral. 70, 1-2.
Google Scholar
Skriv et svar