14.8 Ethere
Læringsmål
- Beskriv den strukturelle forskel mellem en alkohol og en ether, der påvirker deres fysiske egenskaber og reaktivitet.
- Nævn simple ethere.
- Beskriv nogle eteres opbygning og anvendelsesformål.
Med den generelle formel ROR′ er en eterEn organisk forbindelse, der har et oxygenatom mellem to kulbrintegrupper. kan betragtes som et derivat af vand, hvor begge hydrogenatomer er erstattet af alkyl- eller arylgrupper. Det kan også betragtes som et derivat af en alkohol (ROH), hvor hydrogenatomet i OH-gruppen er blevet erstattet af en anden alkyl- eller arylgruppe:
HOH→H-atomererstatter beggeROR′←′af OH-gruppenerstatter H-atomROH
Enkle etere har enkle fællesnavne, der er dannet af navnene på de grupper, der er knyttet til oxygenatomet, efterfulgt af det generiske navn ether. F.eks. er CH3-O-CH2CH2CH2CH3 methylpropylether. Hvis begge grupper er de samme, skal gruppens navn indledes med præfikset di-, som i dimethylether (CH3-O-CH3) og diethylether CH3CH2-O-CH2CH3.
Ethermolekyler har intet hydrogenatom på oxygenatomet (dvs. ingen OH-gruppe). Der er derfor ingen intermolekylær hydrogenbinding mellem etermolekyler, og etere har derfor et ret lavt kogepunkt for en given molarmasse. Faktisk har etere kogepunkter omtrent det samme som for alkaner med sammenlignelig molarmasse og meget lavere end for de tilsvarende alkoholer (Tabel 14.4 “Sammenligning af kogepunkterne for alkaner, alkoholer og etere”).
Tabel 14.4 Sammenligning af kogepunkterne for alkaner, alkoholer og ethere
| Kondenseret strukturformel | Navn | Molarmasse | Kogepunkt (°C) | Intermolekylær hydrogenbinding i ren væske? | |
|---|---|---|---|---|---|
| CH3CH2CH3 | propan | 44 | -42 | nej | |
| CH3CHOCH3 | dimethylether | 46 | -25 | nej | |
| CH3CH2OH | ethylalkohol | 46 | 78 | ja | |
| CH3CH3CH2CH2CH2CH2CH3 | pentan | 72 | 36 | nej | |
| CH3CH2OCH2CH3 | diethylether | 74 | 35 | nej | |
| CH3CH2CH2CH2CH2OH | butylalkohol | 74 | 117 | ja |
Ethermolekyler har et oxygenatom, og indgår i hydrogenbinding med vandmolekyler. Derfor har en eter omtrent den samme opløselighed i vand som den alkohol, der er isomer med den. F.eks. er dimethylether og ethanol (begge med molekylformlen C2H6O) fuldstændig opløselige i vand, mens diethylether og 1-butanol (begge C4H10O) er knapt opløselige i vand (8 g/100 mL vand).
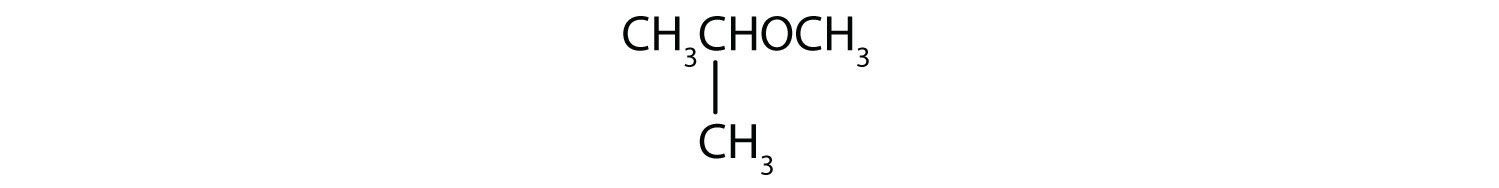
Eksempel 5
Hvad er det almindelige navn for hver ether?
- CH3CH2CH2CH2OCH2CH2CH2CH3
-
Løsning
- Kulstofgrupperne på hver side af oxygenatomet er propylgrupper (CH3CH2CH2CH2), så forbindelsen er dipropylether.
- Den tre kulstofgrupper er knyttet ved det midterste kulstofatom, så det er en isopropylgruppe. Den ene kulstofgruppe er en methylgruppe. Forbindelsen er isopropylmethylether.
Skill-Bygningsøvelse
-
CH3CH2CH2CH2CH2OCH2CH2CH2CH2CH2CH3
-
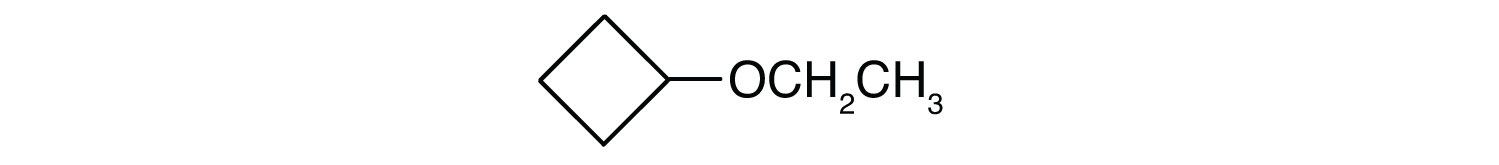
Hvad er det almindelige navn for hver eter?
Til dit helbred: Ethere som generelle bedøvelsesmidler
Et generelt bedøvelsesmiddel virker på hjernen og fremkalder bevidstløshed og en generel følelses- og smertefølsomhed. Diethylether (CH3CH2OCH2CH3) var det første generelle bedøvelsesmiddel, der blev anvendt.
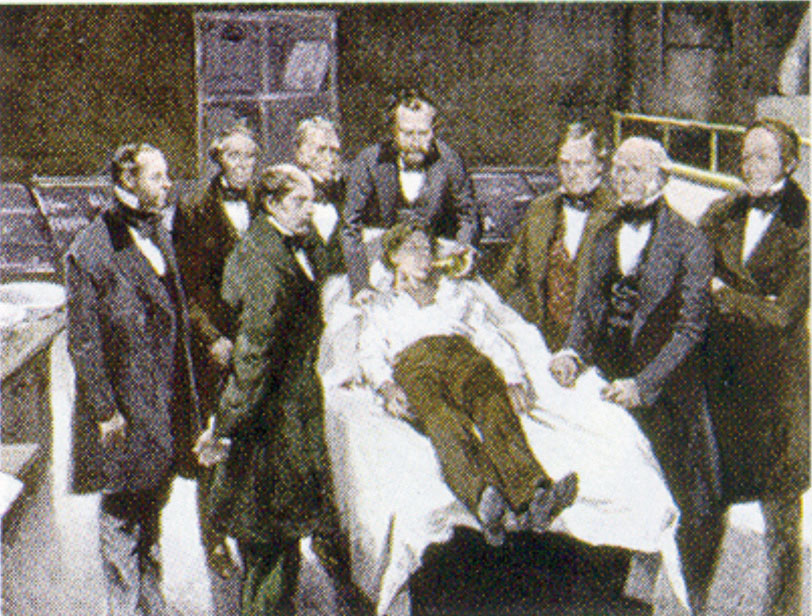
William Morton, en tandlæge fra Boston, introducerede diethylether i kirurgisk praksis i 1846. Dette maleri viser en operation i Boston i 1846, hvor diethylæter blev brugt som bedøvelsesmiddel. Indånding af æterdamp giver bevidstløshed ved at nedtvinge aktiviteten i centralnervesystemet.
Kilde: Kilde: Maleri af William Morton af Ernest Board, fra http://commons.wikimedia.org/wiki/File:Morton_Ether_1846.jpg.
Diethylether er relativt sikkert, fordi der er en forholdsvis stor forskel mellem den dosis, der giver et effektivt bedøvelsesniveau, og den dødelige dosis. Da det imidlertid er meget brandfarligt og har den yderligere ulempe, at det forårsager kvalme, er det blevet erstattet af nyere inhalationsanæstetika, herunder de fluorholdige forbindelser halothan, enfluran og isofluran. Desværre er der blevet sat spørgsmålstegn ved disse stoffers sikkerhed for personalet på operationsstuerne. F.eks. lider kvindelige ansatte på operationsstuer, der udsættes for halothan, i højere grad af aborter end kvinder i den almindelige befolkning.
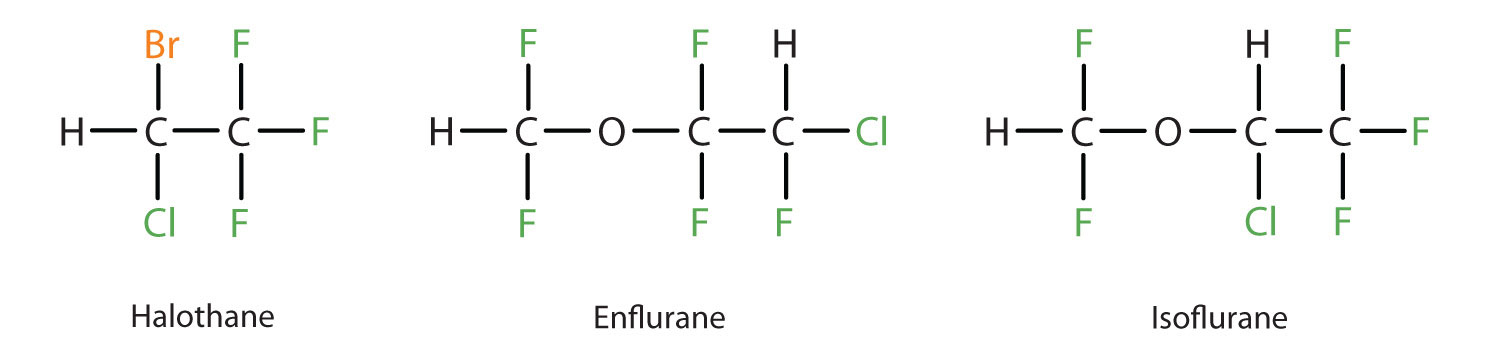
Disse tre moderne, inhalerende, halogenholdige anæstesiforbindelser er mindre brandfarlige end diethylether.
Begrebsgennemgang øvelser
-
Hvorfor har diethylether (CH3CH2OCH2CH2CH3) et meget lavere kogepunkt end 1-butanol (CH3CH2CH2CH2CH2OH)?
-
Hvilket er mest opløseligt i vand – diethylethanol (CH3CH2OCH3) eller 1-butanol (CH3CH2CH2CH2CH2OH)? Forklar.
Svar
-
Diethylether har ingen intermolekylær hydrogenbinding, fordi der ikke er nogen OH-gruppe; 1-butanol har en OH-gruppe og indgår i intermolekylær hydrogenbinding.
-
Ethylmethylether (tre kulstofatomer, et oxygenatom) er mere opløseligt i vand end 1-butanol (fire kulstofatomer, et oxygenatom), selv om begge kan indgå i hydrogenbinding med vand.
Nøglepunkter
- For at give etere almindelige navne skal man blot nævne de grupper, der er knyttet til oxygenatomet, efterfulgt af det generiske navn ether. Hvis begge grupper er de samme, skal gruppenavnet indledes med præfikset di-.
- Ethermolekyler har ingen OH-gruppe og dermed ingen intermolekylær hydrogenbinding. Ethere har derfor et ret lavt kogepunkt for en given molarmasse.
- Ethermolekyler har et oxygenatom og kan indgå i hydrogenbinding med vandmolekyler. Et ethermolekyle har omtrent samme opløselighed i vand som den alkohol, der er isomer med det.
Opgaver
-
Hvordan kan ethanol give to forskellige produkter, når det opvarmes med svovlsyre? Nævn disse produkter.
-
Hvilken af disse ethere er isomerisk med ethanol-CH3CH2OCH2CH3, CH3OCH2CH3 eller CH3OCH3?
-
Nævn hver forbindelse.
- CH3OCH2CH2CH2CH3
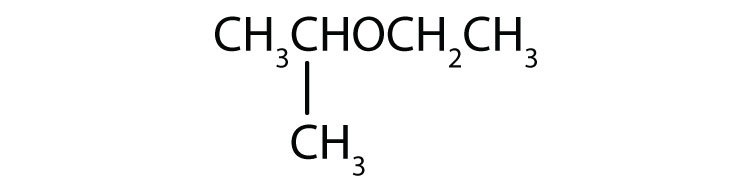
Nævn hver forbindelse.
- CH3CH2CH2CH2CH2OCH3
- CH3CH2OCH2CH2CH2CH3
Tegn strukturen for hver forbindelse.
- methylethylether
- tert-butylethylether
Tegn strukturen for hver forbindelse.
- diisopropylether
- cyclopropylpropylether
Svar
-
Intramolekylær (både H og OH kommer fra det samme molekyle) dehydrering giver ethylen; intermolekylær (H kommer fra et molekyle og OH kommer fra et andet molekyle) dehydrering giver diethylether.
-
- methylpropylether
- ethylisopropylether
-
- CH3OCH2CH3
-
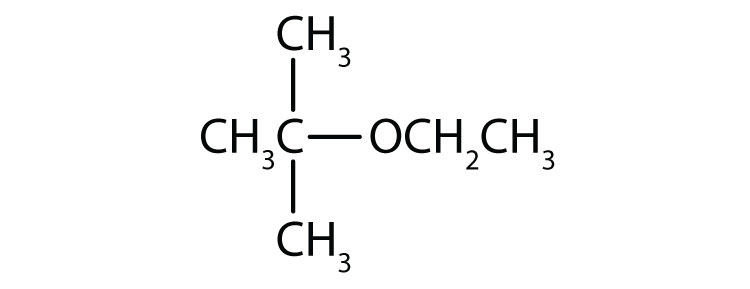
Skriv et svar