Rene stoffer og blandinger
Et rent kemisk stof er ethvert stof, der har en fast kemisk sammensætning og karakteristiske egenskaber. Ilt er f.eks. et rent kemisk stof, som er en farveløs, lugtfri gas ved 25°C. Meget få stofprøver består af rene stoffer; i stedet er de fleste af dem blandinger, som er kombinationer af to eller flere rene stoffer i varierende proportioner, hvor de enkelte stoffer bevarer deres identitet. Luft, ledningsvand, mælk, blåskimmelost, brød og snavs er alle blandinger. Hvis alle dele af et materiale er i samme tilstand, ikke har nogen synlige grænser og er ensartede overalt, er materialet homogent. Eksempler på homogene blandinger er den luft, vi indånder, og det ledningsvand, vi drikker. Homogene blandinger kaldes også for opløsninger. Luft er således en opløsning af kvælstof, ilt, vanddamp, kuldioxid og flere andre gasser, og ledningsvand er en opløsning af små mængder af flere stoffer i vand. De specifikke sammensætninger af begge disse opløsninger er imidlertid ikke faste, men afhænger af både kilde og sted; f.eks. er sammensætningen af ledningsvand i Boise, Idaho, ikke den samme som sammensætningen af ledningsvand i Buffalo, New York. Selv om de fleste opløsninger, vi møder, er flydende, kan opløsninger også være faste. Det grå stof, som nogle tandlæger stadig bruger til at fylde huller i tænderne, er en kompleks fast opløsning, der indeholder 50 % kviksølv og 50 % af et pulver, der hovedsagelig indeholder sølv, tin og kobber med små mængder zink og kviksølv. Faste opløsninger af to eller flere metaller kaldes almindeligvis for legeringer.
Hvis sammensætningen af et materiale ikke er helt ensartet, er det heterogent (f.eks. chokoladekagedej, blåskimmelost og snavs). Blandinger, der ser ud til at være homogene, viser sig ofte at være heterogene efter en mikroskopisk undersøgelse. Mælk ser f.eks. ud til at være homogen, men når man undersøger den i mikroskop, er det tydeligt, at den består af små fedt- og proteinkugler, der er spredt i vand. Komponenterne i heterogene blandinger kan normalt adskilles med enkle midler. Blandinger af faste stoffer og væsker, f.eks. sand i vand eller teblade i te, kan let adskilles ved filtrering, som består i at lade blandingen passere gennem en barriere, f.eks. en si, med huller eller porer, der er mindre end de faste partikler. I princippet kan blandinger af to eller flere faste stoffer, som f.eks. sukker og salt, adskilles ved mikroskopisk inspektion og sortering. Det er dog normalt nødvendigt med mere komplekse operationer, f.eks. når man adskiller guldklumper fra flodgrus ved panering. Først filtreres fast materiale fra flodvandet, og derefter adskilles de faste stoffer ved inspektion. Hvis guldet er indlejret i sten, kan det være nødvendigt at isolere det ved hjælp af kemiske metoder.
-and-Milk-(left).jpg?revision=1)
Figur 1.2.2: En heterogen blanding. Under et mikroskop er sødmælk faktisk en heterogen blanding, der består af fedt- og proteinkugler, der er spredt i vand. Figur anvendt med tilladelse fra Wikipedia
Homogene blandinger (opløsninger) kan adskilles i deres bestanddele ved fysiske processer, der er baseret på forskelle i nogle fysiske egenskaber, f.eks. forskelle i deres kogepunkter. To af disse adskillelsesmetoder er destillation og krystallisering. Destillation gør brug af forskelle i flygtighed, et mål for, hvor let et stof omdannes til en gas ved en given temperatur. Et simpelt destillationsapparat til adskillelse af en blanding af stoffer, hvoraf mindst ét er en væske. Den mest flygtige bestanddel koger først og kondenseres tilbage til en væske i den vandkølede kondensator, hvorfra den løber ud i den modtagende kolbe. Hvis der f.eks. destilleres en opløsning af salt og vand, samles den mest flygtige komponent, rent vand, i modtagerkolben, mens saltet forbliver i destillationskolben.

Figur 1.2.3: Destillation af en opløsning af bordsalt i vand. Opløsningen af salt i vand opvarmes i destillationskolben, indtil den koger. Den resulterende damp er beriget med den mere flygtige komponent (vand), som kondenserer til en væske i den kolde kondensator og derefter opsamles i modtagerkolben.
Blandinger af to eller flere væsker med forskellige kogepunkter kan adskilles med et mere kompliceret destillationsapparat. Et eksempel er raffinering af råolie til en række nyttige produkter: flybrændstof, benzin, petroleum, dieselolie og smøreolie (i den omtrentlige rækkefølge af faldende flygtighed). Et andet eksempel er destillation af alkoholisk spiritus som f.eks. brandy eller whisky. Denne relativt enkle procedure gav mere end et par hovedpiner til de føderale myndigheder i 1920’erne under forbudstiden, da ulovlige destillationsanlæg spredte sig i fjerntliggende regioner i USA.
Krystallisation adskiller blandinger baseret på forskelle i opløselighed, et mål for, hvor meget fast stof der forbliver opløst i en given mængde af en bestemt væske. De fleste stoffer er mere opløselige ved højere temperaturer, så en blanding af to eller flere stoffer kan opløses ved en forhøjet temperatur og derefter afkøles langsomt. Alternativt kan man lade væsken, der kaldes opløsningsmidlet, fordampe. I begge tilfælde danner det mindst opløselige af de opløste stoffer, det stof, der er mindst tilbøjeligt til at forblive i opløsning, normalt krystaller først, og disse krystaller kan fjernes fra den resterende opløsning ved filtrering.

Figur 1.2.4: Krystallisation af natriumacetat fra en koncentreret opløsning af natriumacetat i vand. Tilsætning af en lille “frøkrystal” (a) bevirker, at forbindelsen danner hvide krystaller, som vokser og til sidst optager det meste af kolben. Videoen kan findes her: https://www.youtube.com/watch?v=BLq5NibwV5g
De fleste blandinger kan adskilles i rene stoffer, som enten kan være grundstoffer eller forbindelser. Et grundstof, f.eks. gråt, metallisk natrium, er et stof, der ikke kan nedbrydes til enklere stoffer ved kemiske ændringer; en forbindelse, f.eks. hvidt, krystallinsk natriumklorid, indeholder to eller flere grundstoffer og har kemiske og fysiske egenskaber, der normalt adskiller sig fra egenskaberne for de grundstoffer, som den er sammensat af. Med få undtagelser har en bestemt forbindelse den samme grundstofsammensætning (de samme grundstoffer i de samme proportioner) uanset dens oprindelse eller historie. Den kemiske sammensætning af et stof ændres i en proces, der kaldes en kemisk ændring. Omdannelsen af to eller flere grundstoffer, f.eks. natrium og klor, til en kemisk forbindelse, natriumklorid, er et eksempel på en kemisk ændring, der ofte kaldes en kemisk reaktion. På nuværende tidspunkt er der ca. 115 grundstoffer kendt, men der er fremstillet millioner af kemiske forbindelser af disse 115 grundstoffer. De kendte grundstoffer er opført i det periodiske system.
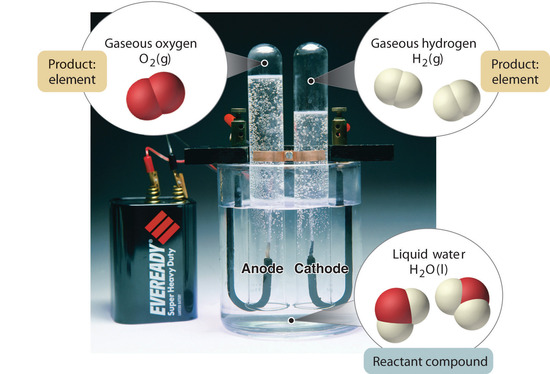
Figur 1.2.5: Nedbrydning af vand til brint og ilt ved elektrolyse. Vand er en kemisk forbindelse; brint og ilt er grundstoffer.
Generelt nedbrydes forbindelser til deres grundstoffer ved en omvendt kemisk proces. For eksempel kan vand (en forbindelse) nedbrydes til brint og ilt (begge grundstoffer) ved en proces, der kaldes elektrolyse. Ved elektrolyse leverer elektricitet den energi, der er nødvendig for at adskille en forbindelse i dens bestanddele (figur 1.2.5). En lignende teknik anvendes i stor skala til at fremstille rent aluminium, et grundstof, fra dets malme, som er blandinger af forbindelser. Da der kræves en stor mængde energi til elektrolyse, er prisen på elektricitet langt den største udgift ved fremstilling af rent aluminium. Genbrug af aluminium er således både omkostningseffektivt og miljømæssigt forsvarligt. Den overordnede organisering af stoffet og de metoder, der anvendes til at adskille blandinger, er opsummeret i figur 1.2.6.
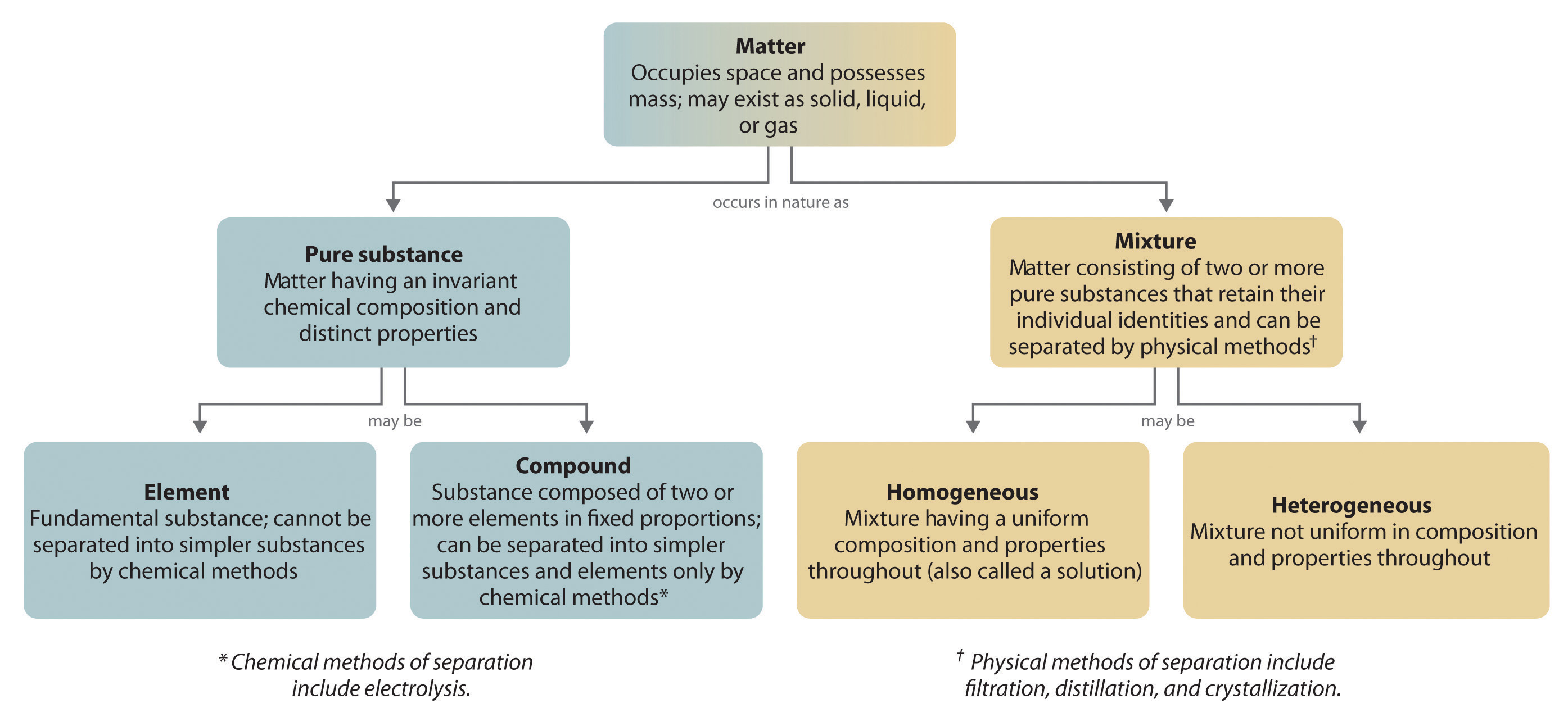
Figur 1.2.6: Sammenhænge mellem stoftyperne og de metoder, der anvendes til at adskille blandinger
Eksempel 1.2.1
Identificer hvert stof som en forbindelse, et grundstof, en heterogen blanding eller en homogen blanding (opløsning).
- filtreret te
- friskpresset appelsinsaft
- en compact disc
- aluminiumoxid, et hvidt pulver, der indeholder en 2:3-forholdet mellem aluminium- og oxygenatomer
- selen
Givet: et kemisk stof
Spørges om: dets klassificering
Strategi:
- Beslut, om et stof er kemisk rent. Hvis det er rent, er stoffet enten et grundstof eller en forbindelse. Hvis et stof kan adskilles i dets grundstoffer, er det en forbindelse.
- Hvis et stof ikke er kemisk rent, er det enten en heterogen blanding eller en homogen blanding. Hvis dets sammensætning er ensartet overalt, er det en homogen blanding.
Løsning:
- En te er en opløsning af forbindelser i vand, så den er ikke kemisk ren. Det adskilles normalt fra tebladene ved filtrering. B Da opløsningens sammensætning er ensartet overalt, er det en homogen blanding.
- A Appelsinsaft indeholder både partikler af fast stof (pulp) og væske; den er ikke kemisk ren. B Fordi dens sammensætning ikke er ensartet overalt, er appelsinsaft en heterogen blanding.
- A En compact disc er et fast materiale, der indeholder mere end ét grundstof, med områder med forskellige sammensætninger, der er synlige langs dens kant. Derfor er en compact disc ikke kemisk ren. B Områderne med forskellig sammensætning viser, at en compact disc er en heterogen blanding.
- A Aluminiumoxid er en enkelt, kemisk ren forbindelse.
- A Selen er et af de kendte grundstoffer.
Øvelse 1.2.1
Identificer hvert stof som en forbindelse, et grundstof, en heterogen blanding eller en homogen blanding (opløsning).
- hvidevin
- kviksølv
- kranse-salatdressing
- bordsukker (saccharose)
Svar:
- opløsning
- element
- heterogen blanding
- forbindelse
Summarum
Materie kan klassificeres efter fysiske og kemiske egenskaber. Materie er alt, der optager rum og har masse. De tre stoftilstande er fast stof, væske og gas. En fysisk ændring indebærer, at et stof omdannes fra en stoftilstand til en anden, uden at dets kemiske sammensætning ændres. Det meste stof består af blandinger af rene stoffer, som kan være homogene (ensartede i deres sammensætning) eller heterogene (forskellige områder har forskellige sammensætninger og egenskaber). Rene stoffer kan enten være kemiske forbindelser eller grundstoffer. Forbindelser kan nedbrydes til grundstoffer ved kemiske reaktioner, men grundstoffer kan ikke adskilles til simplere stoffer ved kemiske midler. Stoffers egenskaber kan klassificeres som enten fysiske eller kemiske. Forskere kan observere fysiske egenskaber uden at ændre stoffets sammensætning, mens kemiske egenskaber beskriver et stofs tendens til at undergå kemiske ændringer (kemiske reaktioner), der ændrer dets kemiske sammensætning. Fysiske egenskaber kan være intensive eller ekstensive. Intensive egenskaber er de samme for alle prøver; de afhænger ikke af prøvens størrelse og omfatter f.eks. farve, fysisk tilstand samt smelte- og kogepunkt. Ekstensive egenskaber afhænger af mængden af materiale og omfatter masse og volumen. Forholdet mellem to ekstensive egenskaber, masse og volumen, er en vigtig intensiv egenskab kaldet densitet.
Kontributors
Modified by Joshua Halpern (Howard University)
Skriv et svar